Citogenética para niños
La citogenética es esencialmente una rama de la genética —aunque también es parte de la biología/citología celular (una subdivisión de la anatomía humana)—, que se ocupa de cómo los cromosomas se relacionan con el comportamiento celular, particularmente con su comportamiento durante la mitosis y la meiosis. Las técnicas utilizadas son la obtención de cariotipos, el análisis de cromosomas con bandeado G, otras técnicas de bandeado citogenético, así como la citogenética molecular, como la hibridación in situ fluorescente (FISH, fluorescent in situ hybridization) y la hibridación genómica comparativa (CGH, comparative genomic hybridization).
Contenido
Historia
Primeros años
Los cromosomas fueron observados por primera vez en células vegetales por Karl Wilhelm von Nägeli en 1842. Su comportamiento en células animales (de salamandra) fue descrito por Walther Flemming, el descubridor de la mitosis, en 1882. El nombre fue acuñado en 1888 por otro anatomista alemán, von Waldeyer.
La siguiente etapa tuvo lugar tras el desarrollo de la genética a principios del siglo XX, cuando se dedujo que el conjunto de cromosomas (el cariotipo) era el portador de los genes. Levitsky parece haber sido el primero en definir el cariotipo como la apariencia fenotípica de los cromosomas somáticos, en contraste con su contenido genético. La investigación del cariotipo humano llevó muchos años para responder a la pregunta más básica: ¿cuántos cromosomas tiene una célula diploide humana normal? En 1912, Hans von Winiwarter recopiló 47 cromosomas en espermatogonias y 48 en oogonias, concluyendo con un mecanismo de determinación sexual XX/XO. Painter en 1922 no estaba seguro de que el número diploide del hombre fuera 46 o 48, optando por 46. Cambió su opinión más tarde de 46 a 48, e insistió de manera acertada en que el hombre tenía un sistema de determinación del sexo XX/XY. Considerando sus técnicas, estos resultados fueron bastante destacables. En los libros de ciencia, se mantuvo durante más de treinta años que el número de cromosomas humanos era de 48. Se necesitaban nuevas técnicas para corregir este error. Joe Hin Tjio , que trabaja en el laboratorio de Albert Levan, fue el responsable de encontrar el enfoque:
Se necesitaban nuevas técnicas para resolver definitivamente el problema:
-
- Utilizando células en cultivo;
- Pretratando células en una solución hipotónica, que penetra y dispersa los cromosomas;
- Deteniendo la mitosis en metafase con una solución de colchicina;
- Aplastando la preparación para forzar a los cromosomas a ponerse en un mismo plano;
- Troceando una fotomicrografía y organizando el resultado en un cariograma indiscutible.
Hasta 1956 no fue generalmente aceptado que el cariotipo del hombre incluía solo 46 cromosomas. Y algo muy importante, que los grandes primates tenían 48 cromosomas. El cromosoma humano 2 se formó mediante la fusión de cromosomas ancestrales, lo que redujo el número.
Aplicaciones en citogenética
Trabajos de McClintock con el maíz
Barbara McClintock empezó su carrera como citogenetista del maíz. En 1931 McClintock y Harriet Creighton demostraron que la recombinación citológica de cromosomas marcados tenía correlación con la recombinación de rasgos genéticos (genes). McClintock, mientras estaba en el Instituto Carnegie, continuó sus estudios previos sobre los mecanismos de rotura de cromosomas y fusión en el maíz. Identificó un evento particular de rotura cromosómica que siempre ocurría en el mismo locus en el cromosoma 9 del maíz, al que denominó "Ds" o locus de "disociación". McClintock continuó su carrera en citogenética estudiando la mecánica y la herencia de los cromosomas rotos y anulares (circulares) del maíz. Durante su trabajos de citogenética, McClintock descubrió los transposones, un hallazgo que finalmente la llevó a ganar el Premio Nobel en 1983.
Poblaciones naturales de Drosophila
En la década de 1930 Dobzhansky y sus colaboradores tomaron Drosophila pseudoobscura y D. persimilis de poblaciones silvestres en California y estados vecinos. Usando la técnica de Painter estudiaron los cromosomas politénicos y descubrieron que las poblaciones silvestres eran polimórficas para las inversiones cromosómicas. Todas las moscas se parecían a cualquiera de las inversiones que portaban: este fue un ejemplo de polimorfismo críptico.
Rápidamente se acumularon pruebas que demostraban que la selección natural era la responsable. Usando un método ideado por L'Heretier y Teissier, Dobzhansky crio poblaciones en jaulas de cría, que permitía alimentarlas, que se reprodujeran y la toma de muestras de las mismas al mismo tiempo que se evitaba que escaparan. Esto tenía la ventaja de descartar la migración como una posible respuesta a los resultados. Las poblaciones que tenían inversiones de frecuencia inicial conocida se podían mantener en condiciones controladas. Se encontró que los diferentes tipos de cromosomas no fluctuaban al azar, como harían de ser idealmente neutros, sino que se ajustaban a algunas frecuencias en las que se estabilizaban. Cuando Dobzhansky publicó la tercera edición de su libro en 1951 estaba convencido de que la morfología de los cromosomas se mantenía en la población por la ventaja de selección de los heterocigotos, como en la mayoría de los polimorfismos.
Anomalías numéricas humanas y aplicaciones médicas
Con la aparición de los procedimientos que permitían una fácil enumeración de los cromosomas, rápidamente se hicieron descubrimientos relacionados con los cromosomas aberrantes o el número de cromosomas. En algunos trastornos congénitos, como el síndrome de Down, la citogenética reveló la naturaleza del defecto cromosómico: una trisomía "simple". Las anormalidades que surgen de eventos de no disyunción pueden causar células con aneuploidía (adiciones o deleciones de cromosomas completos) en uno de los padres o en el feto. En 1959, Lejeune descubrió que los pacientes con síndrome de Down tenían una copia adicional del cromosoma 21. El síndrome de Down también se conoce como trisomía 21.
Otras anomalías cromosómicas descubiertas son las anomalías en cromosomas sexuales. Una hembra que solo posea un cromosoma sexual (el X) padece el síndrome de Turner, un cromosoma X de más en un varón, con 47 cromosomas en total, padece el síndrome de Klinefelter. Muchas más combinaciones pueden aparecer sin ser letales como XXX, XYY y XXXX. La capacidad de los mamíferos para tolerar aneuploidías en cromosomas sexuales deriva de la capacidad de inactivarlos, que se necesita en hembras normales para compensar el tener dos copias del cromosoma. No todos los genes del cromosoma X se inactivan, lo que responde a por qué se observa una diferencia fenotípica en individuos con cromosomas X extra.
La trisomía del 13 se relaciona con el síndrome de Patau y la del 18 con el síndrome de Edward.
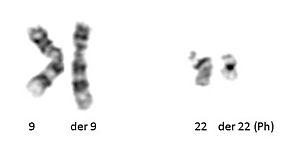
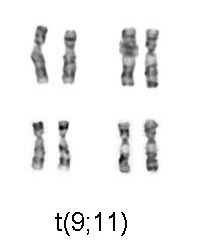
En 1960, Peter Nowell y David Hungerford descubrieron un pequeño cromosoma en los glóbulos blancos de pacientes con leucemia mieloide crónica (LMC, Chronic myelogenous leukemia). Este cromosoma anormal se denominó cromosoma Filadelfia, ya que ambos científicos estaban realizando su investigación en Filadelfia, Pensilvania. Trece años más tarde, con el desarrollo de técnicas más avanzadas, Janet Rowley demostró que el cromosoma anormal era el resultado de una translocación de los cromosomas 9 y 22. La identificación del cromosoma Filadelfia por citogenética es un diagnóstico de CML.
Además, actualmente esta ciencia se está volcando en el uso de sus técnicas, y especialmente la citogenética molecular, para el pronóstico y el diagnóstico de diversos tipos de cáncer. En algunos tipos de cáncer, concretamente en noeplasias hematológicas, los citogenéticos pueden determinar qué translocaciones cromosómicas están presentes en las células malignas, facilitando el diagnóstico y la susceptibilidad al tratamiento (por ejemplo el mesilato de imatinib en casos del cromosoma Filadelfia). En cuanto a otras enfermedades destacan las neoplasias y las hematopatías como diana de las técnicas de citogenética más destacadas.
Aplicaciones en diagnóstico molecular
Dependiendo del tipo de muestra que se tome, se podrá dar un diagnóstico sobre uno o varios casos concretos:
| TIPO DE MUESTRA | APLICACIONES |
|---|---|
| Sangre/células mucosa bucal | Evaluar a una pareja con antecedentes de infertilidad |
| Evaluar una apariencia anormal del cuerpo que sugiere una anomalía genética | |
| Células médula ósea | Análisis casos de leucemia y linfomas |
| Células fetales en líquido amniótico | Diagnóstico prenatal para evaluar anomalías cromosómicas en un feto en desarrollo |
| Células embrionarias | Diagnóstico genético preimplantatorio en técnicas de reproducción asistida |
Aparición de las técnicas de bandeo
A fines de la década de 1960, Torbjörn Caspersson desarrolló una técnica de tinción fluorescente con quinacrina (bandas Q) que revelaba patrones de bandas únicos para cada par de cromosomas. Esto permitía diferenciar pares de cromosomas de igual tamaño mediante distintos patrones de bandas horizontales. Los patrones de bandas se utilizaron entonces para dilucidar los puntos de ruptura y los cromosomas constituyentes involucrados en las translocaciones cromosómicas. Las deleciones e inversiones dentro de un cromosoma individual también se podían identificar y describir con mayor precisión mediante la nomenclatura de bandas estandarizada. El bandeo G (que utiliza tripsina y tinción de Giemsa/Wright) se desarrolló simultáneamente a principios de la década de 1970 y permitía la visualización de patrones de bandas usando un microscopio de campo claro. Los síndromes por deleción como el DiGeorge, el Prader-Willi y otros fueron asociados a deleciones del material cromosómico.
Los diagramas de identificación de los cromosomas basados en los patrones de bandeo, se conocen como idiogramas o mapas citogenéticos. Estos mapas se convirtieron en la base de los campos oncológicos o prenatales y en seguida se incorporaron a citogenéticos en los laboratorios clínicos donde los cariotipos permitían la observación de las alteraciones cromosómicas por parte de los científicos. Las técnicas se ampliaron para el cultivo de amniocitos libres obtenidos del líquido amniótico, y se ampliaron aún más a todo tipo de cultivos que permitieran mayor resolución de bandeo.
Comienzos de la citogenética molecular
En la década de 1980 se hicieron avances en citogenética molecular. Mientras los marcajes con radioisótopos se habían hibridado con el ADN desde 1969, la innovación estaba ahora en las pruebas de marcajes fluorescentes. La hibridación con preparados de cromosomas realizados con las técnicas existentes se pasó a conocer como hibridación fluorescente in situ (FISH, fluorescence in situ hybridization). Este cambio aumentó significativamente el uso de las técnicas de marcaje fluorescente como las técnicas habituales de marcaje por ser más seguras y poder ser utilizadas indefinidamente. Otros avances en la micromanipulación y el examen de cromosomas condujo a las técnicas de microdisección de cromosomas con las que las aberraciones estructurales de cromosomas podían aislarse, clonarse y ser estudiadas con mucho más detalle.
Técnicas
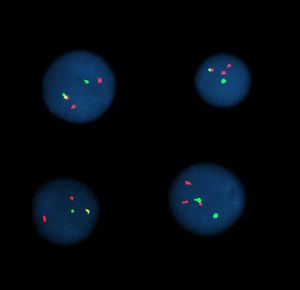
Hibridación por fluorescencia in situ
Hibridación por fluorescencia in situ significa utilizar sondas marcadas por fluorescencia para hibridar preparaciones citogenéticas de células.
Además de en las preparaciones estándar, la técnica FISH también se puede utilizar en:
- frotis de médula ósea
- frotis de sangre
- preparaciones de tejido incluidas en parafina
- muestras de tejido disociadas enzimáticamente
- médula ósea sin cultivar
- amniocitos sin cultivar
- preparaciones de células centrifugadas
Preparación de muestras
La muestra se trata con una solución de sal que normalmente consiste en 2X SSC (sal, citrato de sodio). Después las muestras se deshidratan en etanol, y se añade la mezcla de sondas. La muestra de ADN y la sonda de ADN se codesnaturalizan por calor y dejando un plazo de al menos 4 horas para la reasociación. Tras esto, las muestras se lavan para eliminar el exceso de sondas que no se hayan unido, y se contratiñe con 4',6-Diamidino-2-fenylindol (DAPI) o propidio yodado.
Otras técnicas
Ya se han mencionado las técnicas de uso habitual en análisis citogenético, pero haciendo un resumen de todas ellas y agrupándolas según los campos a los que pertenecen, se tienen:
- Análisis citogenético: aquí se incluyen técnicas como el bandeado G, FISH, CGH (hibridación genómica comparada) o el cariotipo multicolor (SKY-FISH y M-FISH). Estas últimas del cariotipo multicolor son muy recientes y consisten en marcar el material genético de cada cromosoma con uno o varios fluorocromos, haciéndolos así diferenciables. El espectro de emisión de cada uno de ellos es único y así se obtienen cromosomas de diversos colores.
- Análisis molecular: la técnica más destacada en este caso es la PCR (reacción en cadena de la polimerasa), que se caracteriza por su gran aplicabilidad dado que amplifica secuencias específicas de ADN o de ARN, y multiplica por más de 100 el número de copias que se pueden obtener de un fragmento de ADN en concreto, algo muy ventajoso para cualquier estudio que se realice.
Citogenética molecular
Consiste en la combinación de biología molecular y citogenética. Por lo general, esto incluye la utilización de una serie de técnicas del estilo de hibridación por fluorescencia in situ (FISH), en la cual las muestras de ADN están marcadas con diferentes colorantes que emiten fluorescencia para así poder visualizar mejor las regiones específicas del genoma que se quiera. La FISH también puede emplearse para observar directamente los cromosomas metafásicos o los núcleos interfásicos. A parte, se puede tomar un método indirecto en el que el genoma completo es evaluado en cuanto a cambios en el número de copias utilizando un cariotipo virtual. Los cariotipos virtuales se generan a partir de matrices compuestas de miles de millones de muestras, y se usan herramientas computacionales con el fin de hacer una “simulación por ordenador” del genoma.
Futuro de la citogenética
Los avances actualmente se centran en la citogenética molecular, incluyendo técnicas como las matrices de hibridación de genómica comparativa, CGH, matriz-SNP basada en cariotipos y sistemas automatizados para contabilizar los resultados de preparaciones estándar de FISH.
Véase también
 En inglés: Cytogenetics Facts for Kids
En inglés: Cytogenetics Facts for Kids
- Cariotipo
- Citogenética humana
- Citogenética vegetal