Valencia (química) para niños
La valencia es un concepto importante en la química que nos ayuda a entender cómo los átomos se unen para formar moléculas. Imagina que cada átomo tiene "brazos" o "ganchos" con los que puede sujetarse a otros átomos. La valencia nos dice cuántos de esos "brazos" tiene un átomo para combinarse.
En términos más científicos, la valencia se refiere al número de electrones que un elemento químico puede ganar, perder o compartir para unirse con otros elementos. Estos electrones son los que participan en las reacciones químicas y forman los enlaces químicos. Algunos elementos pueden tener diferentes números de "brazos" dependiendo de con qué otro elemento se unan. Por eso, el concepto de valencia ha evolucionado y ahora se usan también los número de oxidación, que son una forma más precisa de describir cómo se combinan los átomos.
A lo largo del siglo XX, la idea de valencia dio lugar a muchas teorías para explicar cómo se forman los enlaces químicos, como la estructura de Lewis y la teoría de los orbitales moleculares.
Contenido
¿Qué es la Valencia Química?
La valencia de un elemento es una medida de su capacidad para unirse con otros átomos. Es como la "fuerza" o "poder" que tiene un átomo para formar compuestos o moléculas.
A veces, se confunden términos como número de coordinación o estado de oxidación con la valencia. Aunque están relacionados, son conceptos diferentes que describen aspectos distintos de cómo los átomos se unen.
La Historia de la Valencia
La palabra "valencia" viene del latín valentía, que significa "poder" o "capacidad". En química, este término se empezó a usar alrededor de 1884 para hablar del "poder de combinación de un elemento".
Primeras Ideas sobre la Combinación de Átomos
En 1789, un químico llamado William Higgins dibujó algunas ideas sobre cómo se combinaban las "partículas últimas" (lo que hoy llamamos átomos). Él pensó que si la fuerza entre una partícula de oxígeno y una de nitrógeno era 6, esa fuerza se dividiría de cierta manera al unirse. Esto fue una de las primeras ideas sobre los enlaces de valencia.
Más tarde, en 1852, Edward Frankland publicó un trabajo importante. Él notó que algunos elementos siempre se combinaban con el mismo número de otros átomos. Por ejemplo, el nitrógeno a menudo se unía en grupos de 3 o 5 átomos. Frankland dijo que esto mostraba una "tendencia o ley" donde el "poder combinatorio" de un elemento siempre se satisface con el mismo número de átomos.
En 1857, August Kekulé propuso que muchos elementos tenían valencias fijas. Por ejemplo, dijo que el carbono siempre tenía una valencia de 4. Esto ayudó a crear las fórmulas estructurales de muchas moléculas, que todavía usamos hoy.
El Papel de los Electrones en la Valencia
El modelo de Rutherford del átomo, de 1911, nos enseñó que los electrones están en la parte exterior del átomo. Esto sugirió que los electrones son los responsables de que los átomos interactúen y formen enlaces.
En 1916, Gilbert N. Lewis explicó la valencia diciendo que los átomos (especialmente los de los grupos principales de la tabla periódica) tienden a tener 8 electrones en su capa más externa, lo que se conoce como la regla del octeto.
Según Lewis:
- En un enlace covalente, los átomos comparten electrones para alcanzar el octeto.
- En un enlace iónico, los átomos transfieren electrones de uno a otro para completar sus octetos.
El término "covalencia" fue introducido por Irving Langmuir en 1919. Él dijo que la covalencia es el número de pares de electrones que un átomo comparte con los átomos vecinos. El prefijo "co-" significa "juntos", así que un enlace covalente significa que los átomos comparten su capacidad de valencia.
Hoy en día, es más común hablar de "enlaces covalentes" en lugar de "valencia" en estudios avanzados. Sin embargo, la valencia sigue siendo muy útil para aprender los conceptos básicos de la química.
¿Cómo se Describe la Valencia?
La capacidad de un átomo para combinarse se puede determinar por cuántos átomos de hidrógeno se unen a él. Por ejemplo:
- En el metano (CH4), el carbono tiene una valencia de 4.
- En el amoníaco (NH3), el nitrógeno tiene una valencia de 3.
- En el agua (H2O), el oxígeno tiene una valencia de 2.
- En el cloruro de hidrógeno (HCl), el cloro tiene una valencia de 1.
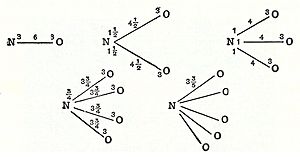
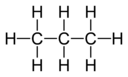
Los diagramas de valencia muestran cómo los elementos están conectados en un compuesto. Las líneas entre los elementos representan los enlaces que se forman.
| Compuesto | H 2 Hidrógeno |
CH 4 Metano |
C 3H 8 Propano |
C 3H 6 Propileno |
C 2H 2 Acetileno |
|---|---|---|---|---|---|
| Diagrama | 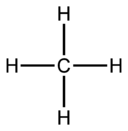 |
 |
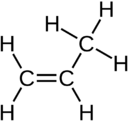 |
||
| Valencias |
|
|
|
|
|
| Compuesto | NH 3 Amoníaco |
NaCN Cianuro de sodio |
PSCl 3 Thiophosphoryl chloride |
H 2S Ácido sulfhídrico |
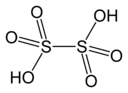
H 2SO 4 Ácido sulfúrico |
H 2S 2O 6 Dithionic acid |
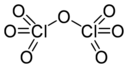
Cl 2O 7 Óxido perclórico |
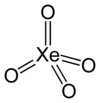
XeO 4 Tetraóxido de xenón |
|---|---|---|---|---|---|---|---|---|
| Diagrama |  |
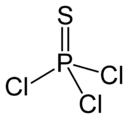 |
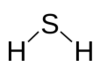 |
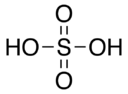 |
 |
 |
 |
|
| Valencias |
|
|
|
|
|
|
|
|
Tipos de Valencia
Existen diferentes formas de describir la valencia de un elemento:
Valencia Positiva Máxima
Es el número más alto de "brazos" que un átomo puede usar para combinarse. Este número suele coincidir con el grupo al que pertenece el elemento en la tabla periódica de los elementos. Por ejemplo, el cloro (Cl) está en el grupo 7, por lo que su valencia positiva máxima es 7.
Valencia Negativa
Esta valencia se usa para describir la capacidad de un átomo de combinarse con otro que tiene valencia positiva. Se calcula viendo cuántos electrones le faltan a un átomo para llegar a 8 en su capa externa, y se le pone un signo negativo. Por ejemplo, al cloro le faltaría 1 electrón para llegar a 8, así que su valencia negativa es -1.
La Valencia Hoy en Día
La Unión Internacional de Química Pura y Aplicada (IUPAC) ha definido la valencia como:
El número máximo de átomos univalentes (como el hidrógeno o el cloro) que pueden combinarse con un átomo de un elemento, o por el que puede ser reemplazado un átomo de ese elemento.
Esta definición busca dar una valencia única a cada elemento, aunque en la práctica, un elemento puede mostrar diferentes capacidades de combinación. La mención del hidrógeno y el cloro se debe a razones históricas, ya que suelen formar enlaces simples.
Las valencias de la mayoría de los elementos se basan en el fluoruro más alto que se conoce.
Véase también
 En inglés: Valence (chemistry) Facts for Kids
En inglés: Valence (chemistry) Facts for Kids