Sulfato de sodio para niños
<th scope="row" style="text://www.ebi.ac.uk/chebi/searchId.do?chebiId=32149 32149]
Datos para niños
Sulfato de sodio |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Sulfato de sodio o tetraoxidosulfato de disodio | ||
| General | ||
| Fórmula estructural | 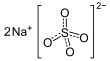 |
|
| Fórmula molecular | Na2SO4 | |
| Identificadores | ||
| Número CAS | 7757-82-6 7727-73-3 (decahidratado) |
|
| Número RTECS | WE1650000 | |
| ChEMBL | CHEMBL233406 | |
| ChemSpider | 22844 | |
| DrugBank | DB09472 | |
| PubChem | 516914, 139036570 24436, 516914, 139036570 | |
| UNII | 36KCS0R750 | |
| KEGG | D01732 C13199, D01732 | |
|
InChI
InChI=InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2
Key: PMZURENOXWZQFD-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Apariencia | Sólido cristalino blanco | |
| Densidad | 2.664 g/cm³ (anhidro) kg/m³; 1.464 g/cm³ (decahidrato) g/cm³ | |
| Masa molar |
142.04 g/mol (anhidro) 322.20 g/mol (decahidro) g/mol |
|
| Punto de fusión | 1157,15 K (884 °C) | |
| Punto de ebullición | 1702,15 K (1429 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 4.76 g/100 mL (0 °C) 42.7 g/100 mL (100 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfato de sodio (Na2SO4) es una sustancia química que se presenta como un sólido blanco y cristalino. Es muy fácil de disolver en agua, pero no tanto en alcohol. Cuando se disuelve en agua, puede hacer que el agua se enfríe un poco.
Una característica interesante del sulfato de sodio es cómo se disuelve en el agua. Su capacidad para disolverse aumenta mucho a medida que la temperatura sube, hasta llegar a los 32.384 °C. A partir de esa temperatura, su solubilidad casi no cambia. Este punto de temperatura es tan preciso que se usa para calibrar termómetros.
Sulfato de Sodio: Un Compuesto Versátil
El sulfato de sodio es un compuesto químico muy útil que se encuentra en la naturaleza y también se produce en fábricas. Se usa en muchas industrias diferentes, desde la fabricación de detergentes hasta la producción de vidrio y papel.
¿Qué es el Sulfato de Sodio?
El sulfato de sodio es una sal, lo que significa que es un compuesto formado por un metal (sodio) y un grupo de átomos llamado sulfato. Su fórmula química, Na2SO4, nos dice que tiene dos átomos de sodio por cada grupo sulfato.
¿Dónde se Encuentra el Sulfato de Sodio?
El sulfato de sodio se puede encontrar de forma natural en algunos minerales y lagos salados. También se produce en grandes cantidades en la industria.
Formas Naturales y Sintéticas
El sulfato de sodio existe en varias formas:
- Sulfato de sodio anhidro (Na2SO4): Esta forma no tiene agua. En la naturaleza, es un mineral raro llamado thenardita. En los laboratorios, se usa para secar otras sustancias.
- Sulfato de sodio decahidratado (Na2SO4 · 10H2O): Esta forma tiene diez moléculas de agua unidas a cada molécula de sulfato de sodio. En la naturaleza, se conoce como el mineral mirabilita. Cuando se obtiene en el laboratorio, se le llama sal de Glauber. Antiguamente, se usaba en medicina.
La mayor parte del sulfato de sodio que se usa en el mundo proviene de fuentes naturales, como los lagos salados. Los países que más lo producen son China, España, México, Rusia, Estados Unidos y Canadá.
¿Para Qué se Usa el Sulfato de Sodio?
El sulfato de sodio es un material económico y muy versátil. Se utiliza en una gran variedad de productos y procesos industriales.
En Detergentes y Limpieza
Uno de los usos más comunes del sulfato de sodio es como relleno en los detergentes en polvo para la ropa. Ayuda a que el detergente tenga la consistencia adecuada y a que se disuelva bien. Sin embargo, su uso en detergentes está disminuyendo, ya que cada vez más personas usan detergentes líquidos o concentrados.
En la Fabricación de Papel
En la industria del papel, el sulfato de sodio es importante para el proceso Kraft, que se usa para fabricar pulpa de celulosa. En este proceso, el sulfato de sodio se transforma en sulfuro de sodio, que es necesario para convertir la madera en pulpa.
En la Industria del Vidrio
El sulfato de sodio también se usa en la fabricación de vidrio. Actúa como un agente clarificante, lo que significa que ayuda a eliminar las pequeñas burbujas de aire que pueden quedar atrapadas en el vidrio fundido. También ayuda a que el vidrio se funda mejor.
En la Industria Textil
En la fabricación de textiles, el sulfato de sodio se añade para ayudar a que los tintes se adhieran de manera uniforme a las fibras de la tela. A diferencia de otras sales, no daña los recipientes de acero inoxidable que se usan para teñir.
Otros Usos Interesantes
- Almacenamiento de calor: Debido a su capacidad para almacenar y liberar calor cuando cambia de estado (de sólido a líquido y viceversa), el sulfato de sodio se puede usar para guardar energía solar y luego liberarla para calentar espacios.
- En alimentos: Se utiliza como un diluyente para los colorantes alimentarios y se conoce como el aditivo número E E514.
- En medicina: Se usa para ayudar al cuerpo a eliminar ciertas sustancias.
Historia del Sulfato de Sodio
El sulfato de sodio fue descubierto en 1625 por un químico llamado Johann Rudolph Glauber. Él lo encontró en manantiales de agua en Austria y lo llamó sal mirabilis, que significa "sal milagrosa", porque se usaba como un laxante. Por eso, todavía se le conoce como "sal de Glauber".
Glauber también fue pionero en la fabricación de esta sal a partir de sal común y ácido sulfúrico. Este proceso marcó un hito importante en el inicio de la industria química. Más tarde, en el siglo XIX, el sulfato de sodio se convirtió en un ingrediente clave para producir carbonato de sodio, una sustancia muy importante para la industria.
Galería de imágenes
Véase también
 En inglés: Sodium sulfate Facts for Kids
En inglés: Sodium sulfate Facts for Kids