Péptido antimicrobiano para niños
Los péptidos antimicrobianos (también conocidos como AMPs) son como pequeños soldados naturales que nuestro cuerpo y otros seres vivos usan para defenderse. Son un tipo de proteínas que tienen la capacidad de combatir microorganismos que pueden causar enfermedades. Piensa en ellos como una parte muy antigua y esencial de nuestro sistema inmunitario, que nos protege desde que nacemos.
Estos péptidos son muy versátiles. Pueden luchar contra diferentes tipos de gérmenes, como bacterias (tanto las Gram positivas como las Gram negativas), hongos y hasta algunos virus. Se encuentran en muchos lugares de la naturaleza: en plantas, insectos, y también en animales, incluyendo a los mamíferos como nosotros.
Contenido
¿Qué son los péptidos antimicrobianos?
Los seres vivos estamos siempre expuestos a muchos patógenos (microorganismos que causan enfermedades). Por eso, necesitamos formas de defendernos. Nuestro sistema inmunitario es el encargado de esta tarea. Una parte de este sistema es la defensa innata, que actúa rápidamente.
Las primeras barreras de defensa son físicas, como nuestra piel o las capas que recubren el estómago y los pulmones. Pero a veces, los microorganismos logran pasar estas barreras. Por ejemplo, en las vías respiratorias, donde el aire entra y sale, pueden aparecer problemas. Es ahí cuando las células epiteliales (las que forman esas capas protectoras) producen péptidos antimicrobianos para protegernos.
Los péptidos antimicrobianos (AMP) son una defensa clave en vertebrados, insectos y plantas. Se producen en diferentes tejidos del cuerpo. Su forma puede ser lineal o en espiral (como una hélice alfa). Algunos ejemplos conocidos son las cecropinas y las magaininas.
Estructura y acción de los péptidos
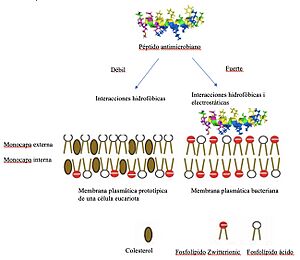
Los AMPs suelen estar formados por entre 12 y 50 aminoácidos, que son los bloques de construcción de las proteínas. Tienen una característica especial: son "anfipáticos". Esto significa que tienen una parte que le gusta el agua y otra que no. Esta característica les ayuda a interactuar con la membrana plasmática de los microorganismos, que es como la piel de la célula. Al hacerlo, pueden crear pequeños agujeros o "poros" en esa membrana, dañando al patógeno.
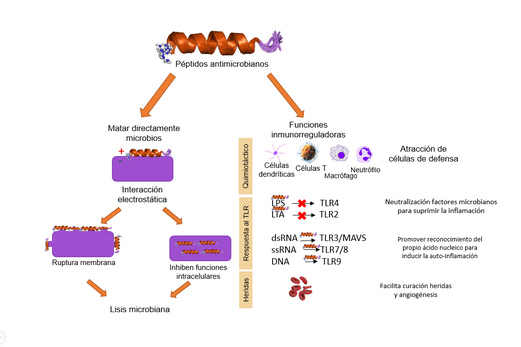
Su forma de actuar es muy variada. No solo matan microbios, sino que también pueden ayudar a regular la inflamación y a reparar tejidos, como en la cicatrización de heridas. Pueden atacar directamente al patógeno dañando su membrana, o pueden entrar en él y afectar procesos internos importantes, como la fabricación de proteínas o la replicación del ADN. También pueden interactuar con las células de nuestro propio cuerpo para fortalecer la respuesta inmune.
Cuando los péptidos antimicrobianos no funcionan bien en los tejidos, pueden causar problemas de salud, como enfermedades digestivas o respiratorias.
Descubrimiento de los péptidos antimicrobianos
La historia de los péptidos antimicrobianos es fascinante:
- En 1922, Alexander Fleming (el mismo que descubrió la penicilina) identificó el primer AMP, al que llamó lisozima.
- En la década de 1960, se encontraron la brombinina en ranas y la lactoferrina en la leche.
- En 1981, Hans Boman descubrió las 'cecropinas', que fueron los primeros AMP con forma de hélice alfa.
- En 1987, Zasloff aisló las magaininas de una rana africana.
- En los años 90, se demostró que los AMPs eran cruciales para la defensa de los insectos. En esa misma década, se descubrieron más de 300 péptidos.
- En 1994, se encontraron AMPs en la piel de mamíferos, lo que confirmó su importancia en nuestra propia defensa.
- Para 2016, ya se habían registrado más de 2500 AMPs en una base de datos especializada.
- En 2021, otra base de datos reportó 3791 AMPs de seis tipos de seres vivos, incluyendo bacterias, plantas y animales.
Tipos de péptidos antimicrobianos
Los péptidos antimicrobianos se pueden clasificar de varias maneras para entenderlos mejor:
Por su estructura
Los AMPs suelen tener dos o más partes con carga positiva. Según su forma, se dividen en:
- Los que tienen forma de hélice alfa (α).
- Los que tienen forma de lámina beta (β), que se debe a la presencia de dos o más enlaces especiales llamados disulfuro.
- Los que tienen forma de loop (bucle), por un solo enlace disulfuro o porque la cadena del péptido se cierra.
- Los que tienen una estructura más extendida.
| Estructura secundaria | Tipo/Carga | Características | Ejemplos | Imagen | |
|---|---|---|---|---|---|
| AMPs aniónicos |
|
Maximina (anfibios), dermicidina (humanos) | |||
| Péptidos catiónicos lineales de α-hélice |
|
LL-37 (humanos), Magainina, dermaseptina, bombinina, brevinina-1, esculentinas y buforina II (anfibios), pleurocidina (peces), CAP18 (conejos), Cecropin P1 (nemátodos) | |||
| Péptidos catiónicos ricos en aminoácidos específicos |
|
Abaecina, apidaecinas (abejas), drosocín (Drosophila), bactenicinas (ovejas), profenina, PR-39 (cerdos), holotripcina (escarabajos), histatina (humano). | |||
| Péptidos aniónicos y catiónicos con cisteína y puentes disulfuro |
|
Péptidos con 1 puente disulfuro: brevinina
Péptidos con 2 puentes disulfuro: protegrina (cerdo), taquiplesinas (cangrejo cacerola) Péptidos con 3 puentes disulfuro: α-defensinas como HBD1, DEFB118 (humano), HNP 1-4 |
|||
| Péptidos aniónicos catiónicos, fragmentos de proteínas mayores |
|
Lactoferricina (de la lactoferrina I), Casodicina (caseína humana), algunos dominios de lactoalbúmina bovina, ovoalbúmina y hemoglobina humana |
Por su origen
También se pueden clasificar según el organismo que los produce:
- Mamíferos
- Anfibios (como la magainina)
- Insectos (como las cecropinas)
- Plantas
- Virus
- Bacterias (llamadas bacteriocinas)
Por su objetivo
Según el tipo de microorganismo que atacan, pueden ser:
- Péptidos antibacterianos
- Péptidos antifúngicos (contra hongos)
- Péptidos antiparasitarios
- Péptidos antivirales
¿Cómo actúan los péptidos antimicrobianos?
Los péptidos antimicrobianos tienen muchas formas de atacar a los gérmenes. Se pueden dividir en dos grupos principales:
- Péptidos que afectan la membrana: Estos péptidos tienen una carga positiva y una parte que se mezcla con las grasas. La membrana de las bacterias tiene cargas negativas, lo que atrae a los péptidos. Una vez que se unen, pueden dañar la membrana de varias maneras:
* Mecanismo de barril: Los péptidos se agrupan y forman un canal en la membrana, como un barril, haciendo que la célula pierda su equilibrio. * Mecanismo anular: Los lípidos de la membrana se doblan y forman un canal junto con los péptidos. * Mecanismo de alfombra: Los péptidos se extienden sobre la superficie de la membrana, como una alfombra, debilitándola hasta que la célula se rompe. * Mecanismo de agregado: A altas concentraciones, los péptidos forman grupos que crean canales y causan la muerte celular.
- Péptidos que no afectan la membrana: Estos péptidos pueden atravesar la membrana y atacar el interior de la célula. Por ejemplo, pueden interferir con el ADN o el ARN polimerasa de las bacterias, impidiendo que crezcan. También pueden alterar la forma en que las bacterias fabrican sus proteínas o cómo se dividen.
Es importante saber que estos péptidos no suelen dañar nuestras propias células. Esto se debe a que las membranas de nuestras células son diferentes a las de las bacterias, lo que impide que los péptidos formen poros en ellas.
Resistencia a los péptidos antimicrobianos
La resistencia de las bacterias a los medicamentos es un problema serio. La buena noticia es que los péptidos antimicrobianos son más difíciles de resistir para las bacterias que los antibióticos comunes. Esto es porque actúan muy rápido y de forma general, lo que da menos tiempo a las bacterias para adaptarse.
Sin embargo, las bacterias pueden desarrollar resistencia. Esto depende de la carga y la estructura de su membrana externa, y de cómo reaccionan a los cambios en su ambiente. Por ejemplo, algunas bacterias pueden modificar su membrana para que los péptidos no puedan entrar. Otras producen enzimas que destruyen los péptidos.
Un mecanismo de resistencia muy común es la formación de biopelículas. Son como capas protectoras que las bacterias crean para esconderse y resistir los ataques. Los científicos están investigando cómo usar los péptidos antimicrobianos para combatir estas biopelículas y las infecciones crónicas que causan.
Función en el sistema inmunitario
Además de matar gérmenes, los péptidos antimicrobianos también ayudan a nuestro sistema inmunitario de otras maneras. Pueden atraer a las células de defensa (como los macrófagos o los linfocitos T) al lugar de la infección. También pueden regular la liberación de otras sustancias que amplifican la respuesta inmune, como las citocinas.
Estos péptidos también son importantes para la curación de heridas y para la formación de nuevos vasos sanguíneos (angiogénesis), que es vital para que los tejidos se recuperen.
Si los péptidos antimicrobianos no funcionan correctamente, pueden contribuir a enfermedades autoinmunes, como la psoriasis o la rosácea.
Usos en medicina
Debido a que las bacterias están desarrollando resistencia a los antibióticos tradicionales, los AMPs son una alternativa muy prometedora para tratar infecciones. Sin embargo, todavía hay desafíos. Los AMPs pueden ser destruidos por algunas sustancias en el cuerpo, lo que dificulta su uso en pastillas o inyecciones. Por ahora, se están estudiando principalmente para aplicar directamente sobre la piel.
Algunos AMPs que se están desarrollando o ya se usan incluyen:
- Boceprevir y Telaprevir, para la Hepatitis C.
- Daptomicina, Teicoplanina, Oritavancina, Telavancina, Vancomicina, Dalbavancina, para infecciones bacterianas.
- Enfuvirtida, para el VIH.
- Bacitracina, para la neumonía, aplicada en la piel.
Además, se está investigando si algunos de estos péptidos podrían ser útiles en la lucha contra el cáncer. Los AMPs tienen la ventaja de que pueden atacar las células cancerosas sin dañar las células sanas.
Tipos especiales de AMPs
Los AMPs naturales se encuentran en la naturaleza, pero los científicos también han creado otros tipos:
AMPs diseñados
Son péptidos creados en laboratorios para tener propiedades específicas. Los científicos modifican AMPs naturales para que sean más efectivos contra los microbios y menos dañinos para las células humanas. Usan computadoras y pruebas en laboratorio para encontrar los mejores diseños.
AMPs encriptados
Son secuencias de péptidos que están "escondidas" dentro de proteínas más grandes. Se descubren usando programas de computadora y se ha visto que son muy activos contra los microbios. Muchos de ellos se forman cuando proteínas más grandes se rompen en pedazos.
AMPs "extintos"
Son péptidos que se han encontrado en el ADN de animales que ya no existen, como los neandertales o los mamuts. Se les han dado nombres como neandertalina o mamutusina. Se ha demostrado que también tienen actividad contra las bacterias.
Véase también
 En inglés: Antimicrobial peptides Facts for Kids
En inglés: Antimicrobial peptides Facts for Kids