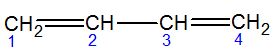Alqueno para niños
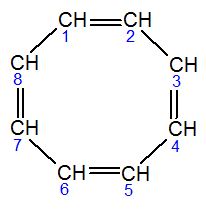
Los alquenos son un tipo de hidrocarburos, que son compuestos formados solo por carbono e hidrógeno. Lo que los hace especiales es que tienen al menos un enlace doble entre dos átomos de carbono en su molécula. Imagina que un alcano (otro tipo de hidrocarburo con solo enlaces simples) pierde dos átomos de hidrógeno, y así se forma un enlace doble. Los alquenos que forman un anillo se llaman cicloalquenos.
Antiguamente, a los alquenos se les conocía como olefinas. Este nombre viene de la palabra "óleo" (aceite), porque los alquenos más simples, como el eteno, reaccionaban con otros elementos para producir sustancias aceitosas.
La Unión Internacional de Química Pura y Aplicada (IUPAC), que es la organización que pone las reglas para nombrar los compuestos químicos, recomienda usar el nombre "alqueno" para los hidrocarburos que no forman anillos y tienen un solo doble enlace. Si tienen dos o más dobles enlaces, se les llama alcadienos o polienos. Para los que forman anillos, se usan nombres como cicloalqueno.
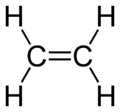
Los alquenos sin anillos, que tienen un solo doble enlace y ningún otro grupo especial, siguen una fórmula general: CnH2n. Esto significa que tienen el doble de átomos de hidrógeno que de carbono. Por ejemplo, si tienen 2 carbonos (n=2), tendrán 4 hidrógenos (2x2=4), como el etileno (C2H4).
Los alquenos suelen ser incoloros y no se mezclan bien con el agua (son "no polares"). Los más pequeños son gases o líquidos a temperatura ambiente. El alqueno más simple, el etileno (también llamado eteno), es muy importante en la industria y se produce en grandes cantidades.
Contenido
¿Cómo se nombran los Alquenos?
La forma de nombrar los alquenos sigue reglas específicas para que todos los científicos los entiendan.
Nombres comunes o tradicionales
Algunos alquenos todavía se conocen por nombres más antiguos. Por ejemplo, al eteno a veces se le llama etileno, y al propeno se le puede llamar propileno. En estos nombres, la terminación "-eno" se cambia por "-ileno".
Nomenclatura sistemática (IUPAC)
Para nombrar los alquenos de forma sistemática, se siguen estos pasos:
- 1. Encontrar la cadena principal: Debes buscar la cadena de átomos de carbono más larga que contenga el doble enlace. Luego, numera los carbonos de esa cadena empezando por el extremo más cercano al doble enlace. Si hay varios dobles enlaces, se busca que tengan los números más bajos posibles.
- 2. Nombrar los sustituyentes: Si hay grupos de átomos (sustituyentes) unidos a la cadena principal, se nombran y se indica su posición con un número. Si hay varios sustituyentes iguales, se usan prefijos como "di-" (dos), "tri-" (tres), "tetra-" (cuatro).
- 3. Orden alfabético: Los sustituyentes se escriben en orden alfabético.
- 4. Nombres complejos: Si un sustituyente es un grupo más complicado, se usa un prefijo como "bis-" (dos), "tris-" (tres), "tetraquis-" (cuatro) y se nombra el grupo entre paréntesis.
- 5. Indicar el doble enlace: Finalmente, se indica la posición del doble enlace con un número, seguido del nombre de la cadena principal y la terminación "-eno".
- 6. Varios dobles enlaces: Si hay más de un doble enlace, se indican todas sus posiciones y se usa un prefijo como "di-" (para dos), "tri-" (para tres) antes de la terminación "-eno". Por ejemplo, "-dieno" o "-trieno".
- 7. Alqueno como sustituyente: Si el alqueno no es la cadena principal, se nombra como un sustituyente con la terminación "-enilo". El carbono unido a la cadena principal se cuenta como el número 1.
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-1993 |
|---|---|---|
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-1993 |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| 1-penteno |
pent-1-eno |
|
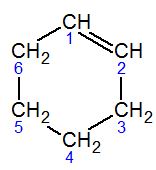
| 1-ciclohexeno | ciclohex-1-eno | |
| 2-buteno | but-2-eno | |
| 3-hepteno | hept-3-eno | |
| 1,3-butadieno | buta-1,3-dieno | |
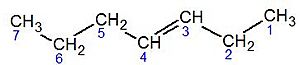
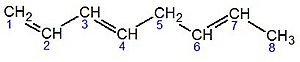
| 1,3,6-octatrieno | octa-1,3,6-trieno | |
| 1,3,5,7-ciclooctatetraeno | cicloocta-1,3,5,7-tetraeno | |
| 3-metil-1-buteno | 3-metil -but-1-eno |
¿Qué es la Isomería Estructural en Alquenos?
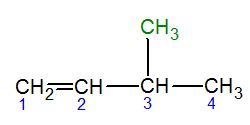
Los alquenos con cuatro o más átomos de carbono pueden tener diferentes formas o estructuras, aunque tengan la misma fórmula química. A esto se le llama isomería estructural. La mayoría de los alquenos también son isómeros de los cicloalcanos.
Algunos ejemplos de isómeros de alquenos son:
- C2H4: Solo existe el etileno.
- C3H6: Solo existe el propileno.
- C4H8: Hay 3 isómeros: 1-buteno, 2-buteno e isobutileno.
- C5H10: Hay 5 isómeros, como el 1-penteno y el 2-penteno.
Además, muchas de estas moléculas pueden presentar cis-trans. Esto significa que los grupos de átomos alrededor del doble enlace pueden estar en el mismo lado (cis) o en lados opuestos (trans). Por ejemplo, en el but-2-eno, los dos grupos metilo pueden estar en el mismo lado (cis-2-buteno) o en lados opuestos (trans-2-buteno). Estos dos isómeros tienen propiedades diferentes.
¿Cómo es el Enlace Doble Carbono-Carbono?
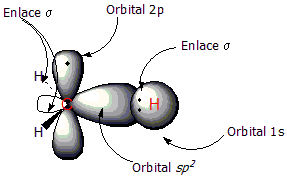
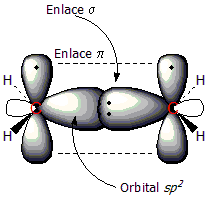
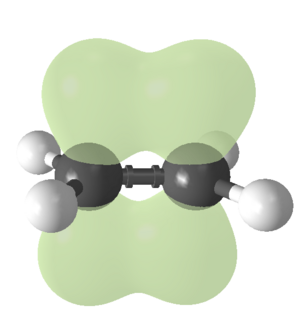
El doble enlace entre dos átomos de carbono (C=C) es muy importante en los alquenos. Está formado por dos tipos de enlaces: un enlace sigma (σ) y un enlace pi (π).
Los dos átomos de carbono que forman el doble enlace se organizan de una manera especial llamada hibridación sp2. Esto significa que sus orbitales (las zonas donde se encuentran los electrones) se mezclan para formar tres nuevos orbitales sp2 que se dirigen hacia las esquinas de un triángulo plano. Estos orbitales forman el enlace sigma entre los dos carbonos.
Además, cada carbono tiene un orbital 2p que no se mezcla. Estos orbitales 2p se encuentran por encima y por debajo del plano de la molécula y se superponen para formar el enlace pi. Los electrones de este enlace pi se mueven por encima y por debajo de los carbonos, lo que hace que el doble enlace sea más fuerte que un enlace simple.
Un doble enlace C=C es más fuerte que un enlace simple C-C, pero no el doble de fuerte. También es más corto que un enlace simple. La rotación alrededor del doble enlace está limitada, lo que permite que existan los isómeros cis y trans de los que hablamos antes.
¿Cómo se obtienen los Alquenos?
Los alquenos se pueden obtener de varias maneras, especialmente en la industria.
Cracking de hidrocarburos
Una forma común de producir alquenos es mediante un proceso llamado cracking. Se toman hidrocarburos más grandes, como los que se encuentran en el gas natural o la nafta, y se calientan a temperaturas muy altas, a veces con la ayuda de un catalizador (una sustancia que acelera la reacción). Esto rompe los hidrocarburos grandes en moléculas más pequeñas, incluyendo alquenos. Luego, estas mezclas se separan.
Deshidrogenación catalítica
Otro método es la deshidrogenación catalítica. En este proceso, un alcano pierde átomos de hidrógeno a altas temperaturas para formar un alqueno. Es como la operación inversa de la hidrogenación, donde se añade hidrógeno.
.
Reacciones de laboratorio
En el laboratorio, los alquenos se pueden sintetizar mediante varias reacciones, como:
- Deshidrohalogenación: Se elimina un átomo de hidrógeno y un átomo de halógeno (como bromo) de una molécula.
* CH3CH2Br + KOH → CH2=CH2 + H2O + KBr
- Deshidratación: Se elimina una molécula de agua de un alcohol.
* CH3CH2OH + H2SO4 → H2C=CH2 + H2SO4 + H2O
- Pirólisis: Se rompen moléculas grandes con calor.
¿Qué propiedades físicas tienen los Alquenos?
Las propiedades físicas de los alquenos son parecidas a las de los alcanos, pero el doble enlace les da algunas características especiales.
- Color y estado: Son incoloros y, al igual que los alcanos, los más pequeños (como el etileno, propeno y buteno) son gases a temperatura ambiente. Los alquenos con más carbonos son líquidos o sólidos cerosos.
- Olor: A menudo tienen olores más fuertes que los alcanos. El etileno, por ejemplo, tiene un olor dulce.
- Polaridad: Aunque en general son no polares, algunos alquenos pueden tener un momento dipolar débil. Esto significa que una parte de la molécula puede tener una ligera carga positiva y otra una ligera carga negativa. Por ejemplo, en el cis-2-buteno hay un momento dipolar neto, pero en el trans-2-buteno, los momentos se anulan y no hay polaridad neta.
- Acidez: Los carbonos del doble enlace en los alquenos son un poco más ácidos que los de los alcanos. Esto significa que pueden perder un protón (un átomo de hidrógeno sin su electrón) con un poco más de facilidad.
¿Cómo reaccionan los Alquenos?
Los alquenos son más reactivos que los alcanos debido a la presencia del doble enlace. Sus reacciones más comunes son las de adición, donde otras moléculas se unen al doble enlace. También son muy importantes en la industria por su capacidad de polimerización.
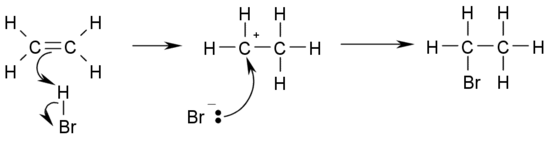
- Hidrohalogenación: Reaccionan con haluros de hidrógeno (como HBr) para formar alcanos halogenados.
Estas reacciones suelen seguir la Regla de Markovnikov, que predice dónde se unirá cada parte de la molécula.
- Hidrogenación: Se les añade hidrógeno en presencia de un catalizador (como platino, paladio o níquel) para formar alcanos.
* CH2=CH2 + H2 → CH3CH3
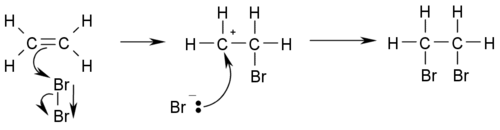
- Halogenación: Reaccionan con halógenos (como bromo) para formar alcanos con dos átomos de halógeno.
- Polimerización: Muchos alquenos pueden unirse entre sí repetidamente para formar moléculas muy grandes llamadas polímeros. Un ejemplo importante es el polietileno, que se forma a partir de muchas moléculas de etileno.
* n CH2=CH2 → (-CH2-CH2-)n
Galería de imágenes
Véase también
 En inglés: Alkene Facts for Kids
En inglés: Alkene Facts for Kids