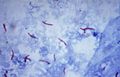
Bacilo de Koch para niños
Datos para niños
Bacilo de Koch |
||
|---|---|---|
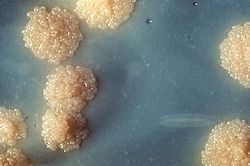 Colonias de Mycobacterium tuberculosis sobre un medio de cultivo.
|
||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Actinobacteria | |
| Orden: | Actinomycetales | |
| Familia: | Mycobacteriaceae | |
| Género: | Mycobacterium | |
| Especie: | M. tuberculosis Zopf, 1883 |
|
| Sinonimia | ||
|
Tubercle bacillus Koch 1882 |
||
Mycobacterium tuberculosis es una bacteria especial que necesita oxígeno para vivir. Es la principal causa de la tuberculosis en el mundo. El científico Robert Koch la descubrió el 24 de marzo de 1882. Por eso, a esta bacteria también se le conoce como "Bacilo de Koch". Robert Koch recibió un Premio Nobel en 1905 por su importante descubrimiento.
Contenido
¿Cómo es la bacteria Mycobacterium tuberculosis?
Esta bacteria tiene forma de bastón y es muy resistente a ciertos químicos. Necesita oxígeno y un nivel de pH específico para crecer. Puede soportar el frío, la congelación y la sequedad. Sin embargo, no le gusta el calor, la luz del sol ni la luz ultravioleta.
¿Cuánto tarda en crecer?
Mycobacterium tuberculosis crece muy despacio. Se divide solo cada 16 a 20 horas. Si las condiciones no son buenas, puede "dormir" por días o incluso años. El único lugar donde vive naturalmente es en los seres humanos, tanto en personas sanas que la tienen como en personas enfermas.
¿Cómo se destruye esta bacteria?
En el laboratorio, se puede destruir con pasteurización a 80 grados Celsius. Los laboratorios también hacen pruebas para ver qué antibióticos funcionan contra ella.
La pared celular de M. tuberculosis
Esta bacteria tiene una pared celular muy particular. Está cubierta de ceras y un tipo de grasa llamado ácido micólico. Esta pared la hace muy fuerte y difícil de destruir. También es la razón por la que no se tiñe con los métodos comunes de laboratorio. Sin embargo, sí se puede ver con una técnica especial llamada Ziehl-Neelsen. Esta pared también la protege de desinfectantes y de la sequedad.
¿Cómo se cultiva en el laboratorio?
Para estudiar M. tuberculosis, los científicos la cultivan en medios especiales. Los más usados son el medio de Lowenstein Jensen y el medio Ogawa. La bacteria tarda al menos 15 días en crecer lo suficiente para verse a simple vista. A veces, puede tardar hasta ocho semanas. Sus colonias (grupos de bacterias) son de color blanco cremoso, redondas y con una superficie rugosa.
El grupo de Mycobacterium tuberculosis (MTBC)
Cuando hablamos de M. tuberculosis, a menudo nos referimos a un grupo de bacterias llamado MTBC. Este grupo incluye varias especies que son muy parecidas entre sí. Se diferencian principalmente en el tipo de ser vivo al que infectan.
- Bacterias que afectan a humanos: M. tuberculosis y M. africanum.
- Bacterias que afectan a animales: M. bovis, M. caprae y M. pinnipedii (en animales domésticos), y M. microti (en cerdos).
También hay otras especies relacionadas, como M. canetti, M. mundi y M. orygis.
¿Qué enfermedades causa M. tuberculosis?
M. tuberculosis es la causa principal de la tuberculosis. Esta enfermedad es una de las mayores causas de muerte en el mundo por un solo tipo de bacteria. Hay dos formas principales de tuberculosis:
- Tuberculosis latente (90-85% de los casos): La bacteria está en el cuerpo, pero no está activa. La persona no tiene síntomas y no puede contagiar a otros. La bacteria puede permanecer así por muchos años.
- Tuberculosis activa (10-15% de los casos): Si las defensas del cuerpo de una persona se debilitan, la bacteria puede activarse. Esto causa la enfermedad, que afecta principalmente a los pulmones. La persona puede tener tos con sangre, fiebre, sudores y perder peso. En este caso, sí puede contagiar a otros.
Además de la tuberculosis, M. tuberculosis se ha relacionado con otras enfermedades, como:
- Problemas pulmonares: neumonía y EPOC.
- Enfermedades del sistema inmunitario: sarcoidosis y Lupus Eritematoso Sistémico.
- Problemas de metabolismo: diabetes y obesidad.
¿Cómo actúa M. tuberculosis en el cuerpo?
Esta bacteria es muy buena para esconderse dentro de las células del cuerpo. Puede permanecer "dormida" por mucho tiempo sin causar daño. Solo se activa si las defensas del cuerpo se debilitan.
1. La bacteria se transmite por el aire, cuando alguien inhala pequeñas gotas de saliva con la bacteria. 2. Una vez en los pulmones, es "comida" por unas células de defensa llamadas macrófagos. 3. Pero la bacteria es inteligente: evita ser digerida por los macrófagos. 4. Esto lleva a la formación de "granulomas". Son como pequeñas paredes que el cuerpo construye alrededor de las bacterias infectadas para contenerlas.
Tuberculosis latente: la bacteria "dormida"
En la tuberculosis latente, los granulomas encierran a las bacterias. Las defensas del cuerpo controlan la infección. La bacteria entra en un estado inactivo, donde no se divide. Vive en el cuerpo sin causar síntomas.
Tuberculosis activa: la bacteria se despierta
Si las defensas del cuerpo se debilitan, la bacteria se "despierta" y empieza a multiplicarse. Esto puede dañar los macrófagos infectados y liberar más bacterias. Estas bacterias pueden infectar nuevas células y extenderse a otras partes del cuerpo. La persona enferma, tiene síntomas y puede contagiar a otros.
La bacteria permanece latente porque no solo se "duerme", sino que también evita que el sistema inmunitario la detecte y la ataque.
¿Qué hace a M. tuberculosis tan fuerte?
- Su pared celular: La protege de sustancias tóxicas y de las defensas del cuerpo.
- Sistemas de secreción de proteínas: La bacteria libera proteínas que confunden al sistema inmunitario. Esto le ayuda a sobrevivir dentro de las células y a permanecer en los granulomas durante la fase latente.
M. tuberculosis resistentes a medicamentos
Un gran desafío hoy en día es que algunas cepas de M. tuberculosis se han vuelto resistentes a los antibióticos. Esto significa que los medicamentos normales ya no funcionan contra ellas.
- Multirresistentes (MDR): Son bacterias que no responden a dos medicamentos importantes: rifampicina e isoniacida.
- Ultrarresistentes (XDR): Son aún más difíciles de tratar. Son resistentes a rifampicina e isoniacida, y también a otros medicamentos más fuertes.
Los científicos están estudiando los cambios genéticos de estas bacterias para entender por qué se vuelven resistentes.
Galería de imágenes
Véase también
 En inglés: Mycobacterium tuberculosis Facts for Kids
En inglés: Mycobacterium tuberculosis Facts for Kids
- Complejo Mycobacterium tuberculosis
- Tuberculosis