Estructura de las proteínas para niños
La estructura de las proteínas se refiere a cómo las moléculas de proteína se organizan en el espacio. Esta organización depende de la secuencia de sus aminoácidos, de las características del ambiente donde se encuentran y de la presencia de otras sustancias que las ayudan a doblarse de una forma específica.
Contenido
Aminoácidos: Los Ladrillos de las Proteínas
Los aminoácidos son las unidades básicas que forman las proteínas, como si fueran pequeños ladrillos. Cada aminoácido tiene un átomo de carbono central, un grupo amino (que contiene nitrógeno e hidrógeno) y un grupo carboxilo (que contiene carbono, oxígeno e hidrógeno). También tienen una "cadena lateral" que es diferente en cada tipo de aminoácido y les da sus características especiales.
Existen 20 tipos principales de aminoácidos que forman las proteínas en los seres vivos. Aquí te mostramos algunos:
| Nombre | Código de tres letras |
Código de una letra |
Abundancia relativa (%) |
Tipo |
|---|---|---|---|---|
| Alanina | Ala | A | 13.0 | Hidrofóbico |
| Arginina | Arg | R | 5.3 | Cargado (+) |
| Asparagina | Asn | N | 9.9 | Polar |
| Aspartato | Asp | D | 9.9 | Cargado (-) |
| Cisteína | Cys | C | 1.8 | Polar |
| Glutamato | Glu | E | 10.8 | Cargado (-) |
| Glutamina | Gln | Q | 10.8 | Polar |
| Glicina | Gly | G | 7.8 | Neutro |
| Histidina | His | H | 0.7 | Polar, Cargado (+) |
| Isoleucina | Ile | I | 4.4 | Hidrofóbico |
| Leucina | Leu | L | 7.8 | Hidrofóbico |
| Lisina | Lys | K | 7.0 | Cargado (+) |
| Metionina | Met | M | 3.8 | Hidrofóbico |
| Fenilalanina | Phe | F | 3.3 | Hidrofóbico |
| Prolina | Pro | P | 4.6 | Hidrofóbico |
| Serina | Ser | S | 6.0 | Polar |
| Treonina | Thr | T | 4.6 | Polar |
| Triptófano | Trp | W | 1.0 | Polar |
| Tirosina | Tyr | Y | 2.2 | Polar |
| Valina | Val | V | 6.0 | Hidrofóbico |
¿Por Qué las Proteínas se Doblan?
Las proteínas se doblan de una forma específica porque es lo más favorable para ellas. Este proceso es como un rompecabezas donde las piezas se unen de la manera más estable posible. Varias fuerzas y factores ayudan a que esto suceda:
Interacciones Eléctricas
Algunas partes de los aminoácidos tienen cargas eléctricas (positivas o negativas). Estas cargas se atraen entre sí, formando lo que a veces se llama "puentes salinos". Estas uniones ayudan a mantener la forma de la proteína. Sin embargo, si el pH del ambiente (qué tan ácido o básico es) cambia mucho, estas uniones pueden romperse y la proteína pierde su forma.
Enlaces de Hidrógeno
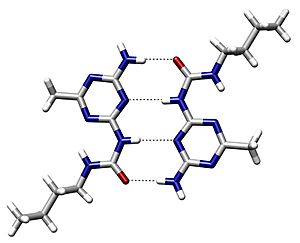
Muchos aminoácidos tienen grupos que pueden formar enlaces de hidrógeno. Estos enlaces son como pequeños imanes que atraen las partes de la proteína entre sí. Aunque cada enlace de hidrógeno es débil por sí solo, la gran cantidad de ellos en una proteína ayuda a estabilizar su estructura.
Fuerzas de Van der Waals
Dentro de las proteínas, las partes sin carga eléctrica también se atraen débilmente. Estas atracciones se llaman fuerzas de Van der Waals. Son muy débiles individualmente, pero como hay muchísimas en una proteína, su suma contribuye a que la estructura sea estable.
Interacciones Hidrofóbicas
Las partes de los aminoácidos que "odian" el agua (llamadas hidrofóbicas) tienden a esconderse en el interior de la proteína cuando esta se dobla. Al hacer esto, el agua que las rodea se vuelve menos ordenada, lo cual es favorable para el sistema. Esta "huida" del agua ayuda a que la proteína se pliegue correctamente y se mantenga estable.
Niveles de Organización de las Proteínas
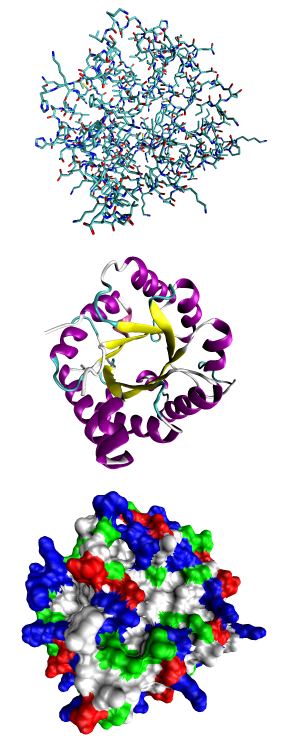
La estructura de las proteínas se describe en varios niveles, como si fueran capas:
Estructura Primaria: La Secuencia de Letras
La estructura primaria es simplemente el orden en que los aminoácidos se unen uno tras otro, como las letras en una palabra. Se unen mediante un tipo de unión fuerte llamada enlace peptídico. Este orden es muy importante porque está definido por la información de nuestro ARN y determina cómo se doblará la proteína más adelante.
Estructura Secundaria: Formas Básicas
La estructura secundaria se refiere a las formas que toma la cadena de aminoácidos en ciertas partes. Esto ocurre gracias a los enlaces de hidrógeno que se forman entre los átomos del esqueleto de la proteína. Las formas más comunes son:
- Hélice alfa: Es como una escalera de caracol. Los aminoácidos se enrollan en una espiral, y las cadenas laterales de los aminoácidos apuntan hacia afuera.
- Lámina beta: Es como una hoja plegada. Varias secciones de la cadena de aminoácidos se alinean una al lado de la otra, formando una estructura plana y estable.
Estructura Terciaria: La Forma 3D Completa
La estructura terciaria es la forma tridimensional completa que toma una proteína cuando se dobla sobre sí misma. Es como si la "escalera de caracol" y las "hojas plegadas" se doblaran y se unieran para formar una figura compleja. En esta etapa, los aminoácidos que "odian" el agua se esconden en el interior, y los que "aman" el agua se quedan en el exterior, en contacto con el agua.
Estructura Cuaternaria: Proteínas con Varias Partes
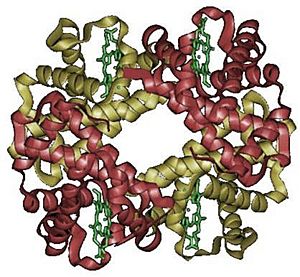
Algunas proteínas son muy grandes y están formadas por varias cadenas de aminoácidos (llamadas subunidades) que se unen entre sí. La estructura cuaternaria describe cómo estas subunidades se organizan y se unen para formar una proteína funcional. Por ejemplo, la hemoglobina, que transporta oxígeno en la sangre, está formada por cuatro subunidades.
Cómo se Mueve y se Dobla una Proteína
Las proteínas no son estáticas; están en constante movimiento, cambiando ligeramente su forma. El proceso de plegamiento de una proteína es muy rápido, ¡puede ocurrir en menos de un segundo! Aunque parece un problema muy complejo, las proteínas tienen formas eficientes de encontrar su forma correcta.
Factores que Afectan la Estructura
- Temperatura: Si la temperatura es demasiado alta (por encima de unos 50 °C), las proteínas pueden perder su forma y dejar de funcionar. Esto se llama desnaturalización.
- pH: Los cambios en el pH (acidez o basicidad) también pueden afectar la forma de las proteínas, ya que alteran las cargas eléctricas de los aminoácidos.
Chaperonas: Las Ayudantes de las Proteínas
Las proteínas llamadas chaperonas son como "entrenadores" o "guías" para otras proteínas. Ayudan a que las proteínas se doblen correctamente después de ser fabricadas o cuando están bajo estrés (por ejemplo, por calor). Las chaperonas no forman parte de la proteína final, solo la asisten en su proceso de plegamiento y transporte dentro de la célula.
Cómo se Descubre la Estructura de las Proteínas
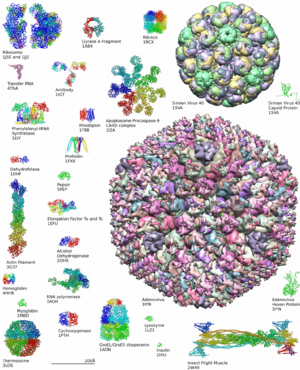
La mayoría de las estructuras de proteínas que conocemos se han descubierto usando una técnica llamada cristalografía de rayos X. Con este método, los científicos pueden ver la distribución de los electrones en la proteína y así determinar la posición exacta de cada átomo en 3D.
Otra técnica importante es la resonancia magnética nuclear, que también ayuda a identificar las formas básicas de las proteínas. Recientemente, el microscopio crioelectrónico se ha vuelto muy útil para estudiar proteínas grandes y complejas, como las que forman las cubiertas de los virus.
Investigación y Futuro
Muchos científicos investigan la estructura de las proteínas porque es clave para entender cómo funcionan los seres vivos y cómo se desarrollan algunas enfermedades. Por ejemplo, enfermedades como el Alzheimer o el Creutzfeldt-Jacob están relacionadas con problemas en el plegamiento de las proteínas.
Hoy en día, se usan programas de computadora muy avanzados para simular cómo se pliegan las proteínas. Proyectos como AlphaFold de Google DeepMind están logrando grandes avances en la predicción de la estructura de las proteínas, lo que ayuda a los científicos a entenderlas mejor.
Véase también
 En inglés: Protein structure Facts for Kids
En inglés: Protein structure Facts for Kids