Estado de oxidación para niños
En química, el estado de oxidación (EO) es un número que nos ayuda a entender cómo se comportan los átomos cuando forman compuestos. Imagina que es una carga eléctrica que un átomo tendría si todos sus enlaces con otros elementos fueran como imanes muy fuertes (100% iónicos).
El estado de oxidación se representa con números que pueden ser positivos, negativos o cero. Por ejemplo, el hierro en la magnetita (Fe3O4) tiene un estado de oxidación promedio de +8/3. El estado de oxidación más alto conocido es +8, que se encuentra en algunos compuestos de elementos como el rutenio o el xenón. El más bajo es -4, que se ve en algunos elementos del grupo del carbono.
Según las reglas de la IUPAC, el estado de oxidación se escribe como un número pequeño arriba y a la derecha del símbolo del elemento, primero el número y luego el signo. Por ejemplo, Al3+.
Contenido
¿Qué es la oxidación y la reducción?
La oxidación ocurre cuando un elemento o compuesto pierde uno o más electrones. Piensa en los electrones como pequeñas partículas con carga negativa. Cuando una sustancia se oxida (pierde electrones), otra sustancia los recibe o los "capta", y a este proceso se le llama reducción. Este intercambio de electrones es la base de las reacciones de óxido-reducción (o redox).
¿Por qué los átomos forman enlaces?
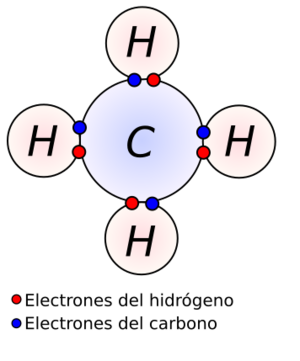
Los átomos buscan ser estables, como los gases nobles, que son muy poco reactivos. Para lograr esta estabilidad, los átomos suelen seguir la regla del octeto. Esta regla dice que un átomo tiende a tener ocho electrones en su capa más externa. En el caso del hidrógeno, busca tener dos electrones, como el helio.
Cuando un átomo necesita, por ejemplo, 3 electrones para completar su octeto, su estado de oxidación será 3- cuando los gane. Si otro átomo tiene 3 electrones que puede ceder, su estado de oxidación será 3+ cuando los pierda. Así es como los átomos se unen para formar compuestos, ya sea compartiendo electrones (enlaces covalentes, como en el agua) o cediéndolos y recibiéndolos (enlaces iónicos, como en la sal de mesa, cloruro de sodio).
Tipos de elementos y sus estados de oxidación
Los elementos químicos se clasifican en tres grandes grupos según cómo se comportan en las reacciones químicas:
También existen los semimetales o metaloides, que pueden actuar como metales o no metales según las condiciones.
Generalmente, los metales (que tienden a ceder electrones) tienen estados de oxidación positivos en los compuestos. Los no metales y semimetales pueden tener estados de oxidación positivos o negativos, dependiendo del compuesto que formen.
Reglas básicas para calcular el estado de oxidación
Para saber el estado de oxidación de un átomo en un compuesto, podemos seguir algunas reglas sencillas:
- El estado de oxidación de un elemento que está solo, sin combinarse con otros (como el Na, Cu, H2 o O2), siempre es cero.
- El hidrógeno (H) casi siempre tiene un estado de oxidación de +1. La excepción son los hidruros metálicos (como el NaH), donde es -1.
- El oxígeno (O) casi siempre tiene un estado de oxidación de -2. Las excepciones son los peróxidos (como H2O2), donde es -1, y en el fluoruro de oxígeno (OF2), donde es +2.
- En los compuestos iónicos, el elemento metálico siempre tiene un estado de oxidación positivo.
- En los compuestos covalentes, el átomo que atrae más fuerte los electrones (el más electronegativo) tiene el estado de oxidación negativo, y los demás son positivos.
- La suma de los estados de oxidación de todos los átomos en un compuesto neutro (sin carga) siempre es cero.
- Si el compuesto es un ion (una molécula con carga), la suma de los estados de oxidación de sus átomos es igual a la carga de ese ion.
Ejemplos de estados de oxidación
Cloruro de sodio (sal de mesa)
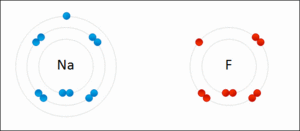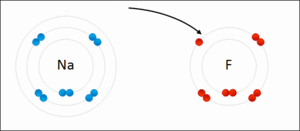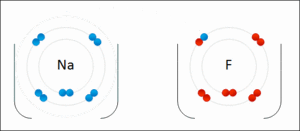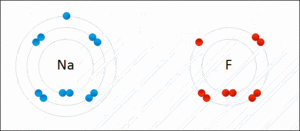
Cuando el sodio (Na) se une con el cloro (Cl) para formar cloruro de sodio (NaCl), ocurre lo siguiente:
- Antes de unirse, el sodio y el cloro tienen un estado de oxidación de 0.
- El sodio cede un electrón, por lo que su estado de oxidación cambia a +1 (Na1+).
- El cloro acepta ese electrón, por lo que su estado de oxidación cambia a -1 (Cl1-).
- La suma de los estados de oxidación en NaCl es (+1) + (-1) = 0, lo que indica que el compuesto es neutro.
Óxido de aluminio
Cuando el aluminio (Al) se une con el oxígeno (O) para formar óxido de aluminio (Al2O3):
- Antes de unirse, el aluminio y el oxígeno tienen un estado de oxidación de 0.
- El aluminio cede tres electrones, por lo que su estado de oxidación es +3 (Al3+).
- El oxígeno acepta dos electrones, por lo que su estado de oxidación es -2 (O2−).
Para que la cantidad de electrones cedidos y aceptados sea igual, la reacción se "balancea". En el óxido de aluminio, necesitamos 2 átomos de aluminio (2 x +3 = +6) y 3 átomos de oxígeno (3 x -2 = -6). Así, la suma total es (+6) + (-6) = 0.
Historia del concepto
El estudio de la oxidación comenzó con Antoine Lavoisier, quien la definió como una reacción con el oxígeno. Con el tiempo, el término se amplió para incluir cualquier pérdida de electrones. Los estados de oxidación fueron importantes para que Dmitri Mendeléyev creara la tabla periódica.
Al principio, se usaban terminaciones como "-ico" para el estado de oxidación más alto de un metal y "-oso" para el más bajo (por ejemplo, cloruro férrico y ferroso). Sin embargo, este sistema era complicado porque los números cambiaban para cada metal.
En 1919, Alfred Stock propuso un sistema mejor, adoptado por la IUPAC en 1940. Este sistema usa números romanos entre paréntesis después del nombre del elemento, como en cloruro de hierro(II). Este método es mucho más claro y se usa hoy en día.
Galería de imágenes
-
En un enlace covalente apolar, los átomos comparten electrones. El átomo más electronegativo (como el carbono aquí) atrae más fuerte los electrones, obteniendo una carga parcial negativa (δ-). El otro átomo (como el hidrógeno) se carga parcialmente de forma positiva (δ+). El estado de oxidación nos ayuda a entender esta interacción: el carbono tiene un EO de -4 y cada hidrógeno +1, sumando la carga total de la molécula (0).
Véase también
 En inglés: Oxidation state Facts for Kids
En inglés: Oxidation state Facts for Kids