Espectro de absorción para niños
El espectro de absorción de un material nos muestra qué parte de la radiación electromagnética (como la luz) es absorbida por ese material en un rango de frecuencias. Es como lo contrario de un espectro de emisión, que muestra la luz que un material libera. Cada elemento químico tiene sus propias "huellas dactilares" de absorción en ciertas longitudes de onda. Esto se debe a las diferencias de energía en los orbitales atómicos de sus átomos.
Por ejemplo, si un objeto absorbe los colores azul, verde y amarillo de la luz blanca, lo veremos de color rojo. La espectroscopia de absorción es una herramienta muy útil en la química analítica. Nos ayuda a saber si una sustancia está presente en una muestra y, a menudo, cuánto hay de esa sustancia. Las técnicas de espectroscopia infrarroja y ultravioleta-visible son muy comunes para esto. También se usa en la física para estudiar moléculas y átomos, en la astronomía y para la teledetección (medir cosas a distancia).
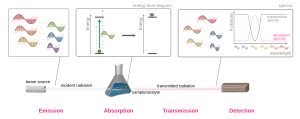
Para medir un espectro de absorción, generalmente se envía un haz de radiación a una muestra y se mide cuánta radiación pasa a través de ella. La energía que atraviesa la muestra nos permite calcular la absorción. La forma en que se hace esto (la fuente de luz, cómo se coloca la muestra y la técnica de detección) cambia mucho según el tipo de radiación y el objetivo del experimento.
Aquí tienes algunos tipos principales de espectroscopia de absorción:
| Tipo de Radiación | Nombre de la Espectroscopia |
|---|---|
| Rayos X | Espectroscopia de absorción de rayos X |
| Ultravioleta–visible | Espectroscopia de absorción UV-vis |
| Infrarrojo | Espectroscopia de absorción IR |
| Microondas | Espectroscopia de absorción de microondas |
| Ondas de radio | Resonancia paramagnética electrónica
Espectroscopía de resonancia magnética nuclear |
Contenido
¿Qué es el Espectro de Absorción?
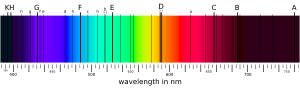
El espectro de absorción de un material es la parte de la radiación que el material absorbe en un rango de frecuencias. La composición de los átomos y moléculas de un material es lo que más influye en su espectro de absorción. Es más probable que la radiación se absorba en frecuencias que coinciden con la diferencia de energía entre dos estados de las moléculas. Cuando la absorción ocurre por un cambio entre dos estados, se le llama línea de absorción. Un espectro suele estar formado por muchas de estas líneas.
Las frecuencias donde aparecen estas líneas de absorción y su intensidad dependen principalmente de la estructura electrónica y estructura molecular de la muestra. También influyen las interacciones entre las moléculas, la estructura cristalina en los sólidos y factores como la temperatura, la presión o los campos eléctricos y magnéticos. Las líneas también tienen un ancho y una forma específicos.
¿Cómo Funciona la Absorción a Nivel Molecular?
Las líneas de absorción se clasifican según el tipo de cambio que ocurre en la molécula o átomo. Por ejemplo, las líneas de rotación aparecen cuando cambia el estado de giro de una molécula y se encuentran en la región de las microondas. Las líneas vibratorias corresponden a cambios en cómo vibran las moléculas y están en la región infrarroja. Las líneas electrónicas se dan cuando cambia el estado electrónico de un átomo o molécula y se ven en las regiones visible y ultravioleta. La absorción de rayos X está relacionada con la excitación de los electrones más internos de los átomos. Estos cambios pueden combinarse, creando nuevas líneas de absorción con la energía total de ambos cambios.
La energía de estos cambios cuánticos determina la frecuencia de la línea de absorción. Sin embargo, esta frecuencia puede variar por interacciones con campos eléctricos y magnéticos, o con moléculas cercanas. Por ejemplo, las líneas de absorción de una molécula en estado gaseoso pueden cambiar mucho si esa molécula está en estado líquido o sólido, donde interactúa más con sus vecinas.
El ancho y la forma de las líneas de absorción dependen del instrumento usado para observarlas, del material que absorbe la radiación y del ambiente físico de ese material. A menudo, las líneas tienen una forma específica, como una distribución gaussiana o lorentziana. A veces, una línea se describe solo por su intensidad y ancho, sin detallar su forma completa.
La intensidad total de una línea de absorción (el área bajo la línea) es proporcional a la cantidad de sustancia que absorbe la radiación. También está relacionada con la temperatura de la sustancia y la interacción entre la radiación y el material.
El ancho de las líneas de absorción puede estar limitado por el espectrómetro que las registra. Si el ancho es mayor que el límite del instrumento, entonces lo determina el entorno del material. Un material líquido o sólido, donde las moléculas interactúan mucho, tiende a tener líneas de absorción más anchas que un gas. Aumentar la temperatura o la presión del material también tiende a ensanchar las líneas. A veces, varias transiciones cercanas se superponen, haciendo que la línea resultante sea aún más ancha.
¿Cómo se Relaciona con la Transmisión y Emisión?
Los espectros de absorción y transmisión contienen la misma información y se pueden calcular uno a partir del otro. Un espectro de transmisión tendrá sus puntos más altos donde la absorción es más débil, porque más luz atraviesa la muestra. Un espectro de absorción tendrá sus puntos más altos donde la absorción es más fuerte.
La emisión es cuando una sustancia libera energía como radiación. La emisión puede ocurrir en las mismas frecuencias que la absorción, lo que permite deducir líneas de absorción de un espectro de emisión. Sin embargo, el espectro de emisión suele tener un patrón de intensidad diferente al de absorción, por lo que no son exactamente iguales.
Los espectros de dispersión y reflexión de un material también están influenciados por su índice de refracción y su espectro de absorción. El espectro de absorción se puede obtener de un espectro de dispersión o reflexión, aunque esto a menudo requiere algunas suposiciones.
Usos del Espectro de Absorción
La espectroscopia de absorción es muy útil en el análisis químico porque es específica y permite medir cantidades. Su especificidad permite distinguir compuestos en una mezcla, lo que la hace valiosa en muchas áreas. Por ejemplo, los analizadores de gases infrarrojos pueden identificar contaminantes en el aire, diferenciándolos del nitrógeno, oxígeno, agua y otros gases.
Esta especificidad también permite identificar muestras desconocidas comparando un espectro medido con una biblioteca de espectros conocidos. En muchos casos, se puede obtener información sobre una muestra incluso si no está en la biblioteca. Por ejemplo, los espectros infrarrojos tienen bandas de absorción características que indican si hay enlaces carbono-hidrógeno o carbono-oxígeno presentes.
Un espectro de absorción se puede usar para saber la cantidad de material presente, aplicando la ley de Beer-Lambert. Para determinar la concentración exacta de un compuesto, se necesita conocer su coeficiente de absorción. Este coeficiente se puede encontrar en fuentes de referencia o se puede medir usando una muestra de calibración con una concentración conocida.
Teledetección: Midiendo a Distancia
Una ventaja única de la espectroscopia es que se pueden hacer mediciones sin que el instrumento y la muestra se toquen. La radiación que viaja entre la muestra y el instrumento lleva la información espectral, permitiendo mediciones a distancia. Esto es muy útil en muchas situaciones. Por ejemplo, se pueden hacer mediciones en ambientes peligrosos sin arriesgar a las personas o los equipos. Además, el material de la muestra no tiene que entrar en contacto con el instrumento, evitando posibles contaminaciones.
Las mediciones espectrales a distancia tienen algunos desafíos. El espacio entre la muestra y el instrumento también puede absorber radiación, lo que podría ocultar o confundir el espectro de la muestra. Estas interferencias de fondo pueden cambiar con el tiempo. La fuente de radiación en mediciones a distancia a menudo es natural, como la luz del Sol o el calor de un objeto, lo que hace necesario distinguir la absorción de la muestra de los cambios en la fuente.
Para simplificar estos desafíos, se ha popularizado la espectroscopia de absorción óptica diferencial. Esta técnica se enfoca en las características de absorción específicas y no en la absorción general, como la causada por aerosoles o la dispersión de Rayleigh. Este método se usa en mediciones desde tierra, aire y satélites.
En la Astronomía: Estudiando el Universo
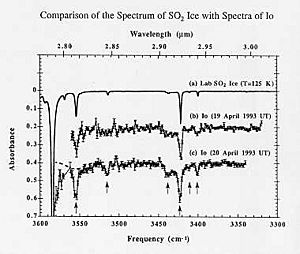
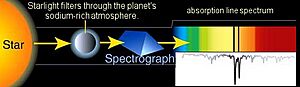
La espectroscopia astronómica es un tipo muy importante de teledetección. En este caso, los objetos de estudio están tan lejos de la Tierra que la radiación electromagnética es la única forma de medirlos. Los espectros astronómicos contienen información tanto de emisión como de absorción. La espectroscopia de absorción ha sido clave para entender las nubes de gas y polvo en el espacio y para descubrir que algunas de ellas contienen moléculas.
También se usa para estudiar planetas extrasolares (planetas fuera de nuestro sistema solar). Cuando un exoplaneta pasa por delante de su estrella (método de tránsito), se puede medir su espectro de absorción. Esto permite determinar la composición de la atmósfera del planeta, su temperatura, presión y altura, e incluso su masa.
En la Física Atómica y Molecular
Los modelos teóricos, especialmente los de mecánica cuántica, nos permiten relacionar los espectros de absorción de átomos y moléculas con otras propiedades físicas, como su estructura electrónica, masa atómica o molecular y su geometría molecular. Por eso, las mediciones del espectro de absorción se usan para determinar estas propiedades. Por ejemplo, la espectroscopia de microondas permite medir con mucha precisión las longitudes y ángulos de los enlaces químicos.
Además, las mediciones espectrales se usan para verificar la precisión de las predicciones teóricas. Por ejemplo, el desplazamiento de Lamb, medido en el espectro de absorción del hidrógeno, no se esperaba cuando se descubrió. Su hallazgo impulsó el desarrollo de la electrodinámica cuántica, y ahora se usa para determinar la constante de estructura fina.
¿Cómo se Mide un Espectro de Absorción?
El Proceso Básico de Medición
La forma más sencilla de hacer espectroscopia de absorción es así: primero, se genera radiación con una fuente. Luego, se mide un espectro de referencia de esa radiación con un fotodetector. Después, se coloca el material que queremos estudiar entre la fuente y el detector, y se mide de nuevo el espectro. Al comparar los dos espectros, podemos saber cuál es el espectro de absorción del material. El espectro de la muestra por sí solo no es suficiente, porque estaría afectado por las condiciones del experimento, como la fuente de luz o la absorción de otros materiales. Pero al comparar con el espectro de referencia, esas influencias se cancelan, y obtenemos solo el espectro de absorción del material.
Se usan muchas fuentes de radiación diferentes para cubrir todo el espectro electromagnético. Para la espectroscopia, es bueno que una fuente cubra un rango amplio de longitudes de onda para medir una gran parte del espectro de absorción. Algunas fuentes emiten un espectro amplio por naturaleza, como los globars (fuentes de cuerpo negro) en infrarrojo, las lámparas de mercurio en visible y ultravioleta, y los tubos de rayos X. Una fuente nueva y muy amplia es la radiación sincrotrón, que cubre todas estas regiones. Otras fuentes emiten un espectro estrecho, pero su longitud de onda se puede ajustar para cubrir un rango. Ejemplos son los klystrons en microondas y los lásers en infrarrojo, visible y ultravioleta.
El detector que se usa para medir la potencia de la radiación también depende del rango de longitudes de onda. La mayoría de los detectores son sensibles a un rango bastante amplio, y la elección del sensor a menudo depende más de la sensibilidad y el ruido que se necesiten. Algunos detectores comunes son los receptores superheterodinos en microondas, los bolómetros en ondas milimétricas e infrarrojas, los detectores semiconductores refrigerados (como el teluro de cadmio mercurio) en infrarrojo, y los fotodiodos y fotomultiplicadores en visible y ultravioleta.
Si tanto la fuente como el detector cubren un rango amplio, también se necesita una forma de separar las longitudes de onda para determinar el espectro. A menudo se usa un espectrógrafo para separar las longitudes de onda de la radiación, de modo que la potencia de cada una se pueda medir por separado. También es común usar la interferometría para determinar el espectro; la espectroscopia infrarroja por transformada de Fourier es un ejemplo muy usado de esta técnica.
Otros dos puntos importantes al preparar un experimento de espectroscopia de absorción son las ópticas (lentes y espejos) para dirigir la radiación y el recipiente para la muestra (llamado cubeta o celda). Para la mayoría de las mediciones UV, visible y NIR, se necesitan cubetas de cuarzo de precisión. En ambos casos, es importante elegir materiales que no absorban mucha radiación en el rango de interés. La absorción de otros materiales podría interferir o tapar la absorción de la muestra. Por ejemplo, en varios rangos de longitud de onda, es necesario medir la muestra al vacío o en un ambiente de gas noble porque los gases de la atmósfera tienen características de absorción que pueden interferir.
Véase también
 En inglés: Absorption spectroscopy Facts for Kids
En inglés: Absorption spectroscopy Facts for Kids