Configuración electrónica para niños
En química, la configuración electrónica es la manera en que los electrones se organizan dentro de un átomo. Imagina que los electrones son como pequeños inquilinos que ocupan diferentes "pisos" y "habitaciones" alrededor del núcleo del átomo. Esta organización sigue un modelo de capas y es muy importante.
La configuración electrónica es clave porque define cómo un átomo se une con otros. Es como su "personalidad química". Por eso, la configuración electrónica también explica la posición de cada elemento en la tabla periódica de los elementos.
Contenido
¿Qué es la Configuración Electrónica?
La forma en que los electrones se organizan en los átomos sigue reglas especiales de la mecánica cuántica, que es la física de las partículas muy pequeñas. La configuración electrónica se basa en los "estados cuánticos" que son como las soluciones a un problema matemático para cada átomo.
El Principio de Exclusión de Pauli
Una regla muy importante es el principio de exclusión de Pauli. Este principio dice que dos electrones en el mismo átomo no pueden tener exactamente el mismo "estado cuántico". Es decir, cada electrón necesita su propio "lugar" único. Si un electrón ya ocupa un lugar, el siguiente electrón debe buscar un lugar diferente.
Los lugares donde es más probable encontrar un electrón se llaman orbitales atómicos. Estos orbitales se describen con cuatro números cuánticos: n, l, ml y ms. El principio de Pauli significa que no puede haber dos electrones en el mismo átomo con los cuatro números cuánticos iguales.
Los electrones pueden cambiar de un orbital a otro. Para hacerlo, necesitan absorber o liberar un pequeño paquete de energía, llamado fotón. Estos cambios de energía explican por qué los átomos emiten o absorben luz.
Notación de la Configuración Electrónica
Para describir cómo se organizan los electrones, usamos una forma especial de escribirlo. Se usan letras y números para indicar dónde están los electrones.
- El número (como 1, 2, 3) indica el nivel de energía o "capa".
- La letra (s, p, d, f) indica el tipo de orbital o "subcapa".
- Un número pequeño arriba (superíndice) dice cuántos electrones hay en ese orbital.
Por ejemplo:
- El hidrógeno tiene un electrón en el orbital 's' de la primera capa, así que su configuración es 1s1.
- El litio tiene dos electrones en la subcapa 1s y uno en la 2s. Su configuración es 1s2 2s1.
- El fósforo (con 15 electrones) tiene la configuración: 1s2 2s2 2p6 3s2 3p3.
Cuando un átomo tiene muchos electrones, la notación puede ser muy larga. Por eso, usamos una forma abreviada. Se toma la configuración de un gas noble (que son muy estables) y se añade lo que falta. Por ejemplo, la configuración del neón es 1s2 2s2 2p6. El fósforo se puede escribir como: [Ne] 3s2 3p3. Esto es útil porque las propiedades químicas de un elemento dependen mucho de sus electrones más externos.
El orden en que se escriben los orbitales sigue la regla de que los electrones llenan primero los orbitales de menor energía. Esto se conoce como la regla de Madelung. Por ejemplo, el hierro se escribe como: [Ar] 4s2 3d6. A veces, se agrupan los orbitales por su número de capa, como [Ar] 3d6 4s2.
Origen Histórico de la Configuración Electrónica
Niels Bohr fue el primero en sugerir en 1923 que las propiedades de los elementos se podían explicar por cómo se organizaban los electrones en el átomo. Su idea se basó en su propio modelo atómico de Bohr, donde los electrones giraban en órbitas fijas alrededor del núcleo.
Un año después, E. C. Stoner mejoró esta descripción. Sin embargo, estos primeros modelos no podían explicar algunos fenómenos, como los cambios en el espectro atómico cuando un átomo está en un campo magnético (conocido como efecto Zeeman).
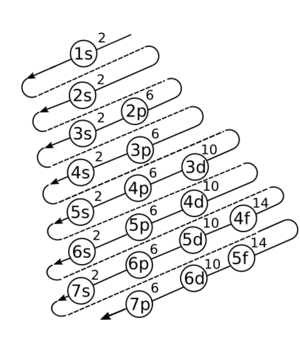
Cómo se Distribuyen los Electrones: Diagrama de Moeller
La distribución de los electrones en los orbitales de un átomo sigue un patrón. Para entenderlo, se usa el diagrama de Moeller.
Para usar el diagrama de Moeller, se siguen las flechas diagonales, llenando los orbitales en ese orden.
| s | p | d | f | |
|---|---|---|---|---|
| k = 1 | 1s | |||
| l = 2 | 2s | 2p | ||
| m = 3 | 3s | 3p | 3d | |
| n = 4 | 4s | 4p | 4d | 4f |
| o = 5 | 5s | 5p | 5d | 5f |
| p = 6 | 6s | 6p | 6d | 6f |
| q = 7 | 7s | 7p | 7d | 7f |
El orden de llenado es:
| 1s | 2s | 2p 3s | 3p 4s | 3d 4p 5s | 4d 5p 6s | 4f 5d 6p 7s | 5f 6d 7p |
Este "principio de construcción" o principio de Aufbau dice que:
- Cada orbital puede tener un máximo de dos electrones.
- Los orbitales se llenan en orden de energía creciente: los de menor energía se llenan primero.
Cada tipo de subnivel puede contener un número máximo de electrones:
- Subnivel 's': hasta 2 electrones.
- Subnivel 'p': hasta 6 electrones.
- Subnivel 'd': hasta 10 electrones.
- Subnivel 'f': hasta 14 electrones.
| s | p | d | f | |
|---|---|---|---|---|
| n = 1 | 2 | |||
| n = 2 | 2 | 6 | ||
| n = 3 | 2 | 6 | 10 | |
| n = 4 | 2 | 6 | 10 | 14 |
| n = 5 | 2 | 6 | 10 | 14 |
| n = 6 | 2 | 6 | 10 | |
| n = 7 | 2 | 6 |
Usando el mismo procedimiento, pero con el número máximo de electrones:
| 1s2 | 2s2 | 2p6 3s2 | 3p6 4s2 | 3d10 4p6 5s2 | 4d10 5p6 6s2 | 4f14 5d10 6p6 7s2 | 5f14 6d10 7p6 |
La configuración electrónica completa, siguiendo este orden, es: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para encontrar la configuración de un elemento, solo tienes que contar sus electrones y distribuirlos en los subniveles, empezando por los de menor energía. Cada elemento tiene un electrón más que el anterior en la tabla periódica.
A veces hay excepciones a estas reglas, especialmente en algunos elementos de transición. Esto ocurre cuando el átomo es más estable si un electrón se mueve a un orbital diferente.
Configuración Electrónica y la Tabla Periódica
La forma de la tabla periódica de los elementos está muy relacionada con la configuración electrónica. Por ejemplo, todos los elementos del grupo 1 tienen una configuración que termina en ns1 (como 1s1, 2s1, etc.). Por eso, tienen propiedades químicas muy parecidas.
La capa de electrones más externa de un átomo se llama "capa de valencia". Esta capa es la que determina las propiedades químicas del elemento. Es interesante que los científicos descubrieron que los elementos de un mismo grupo tenían propiedades similares mucho antes de que se entendiera la configuración electrónica.
La Regla del Octeto
La Regla del octeto es una idea importante en química. Dice que los átomos tienden a ser más estables cuando tienen 8 electrones en su capa más externa. La única excepción es el hidrógeno, que se estabiliza con 2 electrones.
Por ejemplo, el oxígeno tiene 6 electrones en su capa más externa (su configuración termina en 2s2 2p4). Para ser estable, necesita 2 electrones más para llegar a 8. Por eso, el oxígeno tiende a unirse con otros átomos para conseguir esos 2 electrones, como cuando se une con dos átomos de hidrógeno para formar agua (H2O).
En química, un orbital es la zona alrededor del núcleo de un átomo donde es más probable encontrar un electrón.
Ejemplo de la regla del octeto:
- El neón (Ne) tiene 10 electrones: 1s2 2s2 2p6. Su capa más externa (nivel 2) tiene 8 electrones, por eso es un gas noble muy estable.
- El sodio (Na) tiene 11 electrones: 1s2 2s2 2p6 3s1. Su capa más externa (nivel 3) solo tiene 1 electrón. El sodio tiende a perder ese electrón para quedarse con la configuración estable del neón.
Anomalías en la Configuración Electrónica
Aunque la regla de Madelung es muy útil, hay algunas excepciones. A veces, un átomo es más estable si sus orbitales 'd' o 'f' están medio llenos o completamente llenos, incluso si eso significa mover un electrón de un orbital 's'.
Por ejemplo:
- El cromo (Cr) tiene 24 electrones. Según la regla, debería ser 4s2 3d4. Pero es más estable si es 4s1 3d5, porque así el orbital 'd' está medio lleno, lo que le da más estabilidad.
- El cobre (Cu) tiene 29 electrones. En lugar de 4s2 3d9, su configuración correcta es 4s1 3d10, porque el orbital 'd' está completamente lleno, lo que también le da más estabilidad.
Galería de imágenes
Véase también
 En inglés: Electron configuration Facts for Kids
En inglés: Electron configuration Facts for Kids
- Tabla periódica de los elementos
- Valencia (química)
- Electrón
- Número cuántico
- Orbital atómico
- Regla de Hund
- Principio de Aufbau
- Hibridación (química)
- Niels Bohr
- Linus Pauling
- Gases nobles