Óxido de níquel(II) para niños
Datos para niños
Óxido de níquel(II) |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Otros nombres | Monóxido de níquel Oxoníquel |
|
| Fórmula semidesarrollada | Ni | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 1313-99-1 | |
| ChemSpider | 14121 | |
| PubChem | 14805 | |
| UNII | C3574QBZ3Y | |
|
InChI
InChI=InChI=1S/Ni.O
Key: GNRSAWUEBMWBQH-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Sólido verde cristalino | |
| Densidad | 6,67 kg/m³; 0,00667 g/cm³ | |
| Masa molar | 74,6928 g/mol | |
| Índice de refracción (nD) | 2.1818 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El óxido de níquel(II) es un compuesto químico con la fórmula NiO. Es el óxido de níquel más conocido y estudiado. Existe una forma natural de NiO llamada bunsenita, pero es muy poco común. Este compuesto se considera un óxido metálico básico.
Cada año se producen millones de kilogramos de óxido de níquel(II) de diferentes tipos. Se utiliza principalmente como un material intermedio para fabricar aleaciones de níquel.
Contenido
¿Cómo se produce el óxido de níquel(II)?
El óxido de níquel(II) se puede obtener de varias maneras.
Métodos de fabricación
- Cuando el polvo de níquel se calienta a más de 400 °C, reacciona con el oxígeno del aire para formar NiO.
- En la industria, se puede producir óxido de níquel de color verde calentando una mezcla de polvo de níquel y agua a 1000 °C. Añadir un poco de NiO puede hacer que esta reacción sea más rápida.
- La forma más sencilla de producirlo es calentando fuertemente otros compuestos de níquel(II), como el hidróxido, el nitrato o el carbonato. Este proceso se llama pirólisis y produce un polvo de color verde claro.
- Si se calienta el metal níquel directamente con oxígeno, se obtienen polvos de color gris a negro. Esto indica que la proporción de níquel y oxígeno no es exactamente 1:1.
Estructura del óxido de níquel(II)
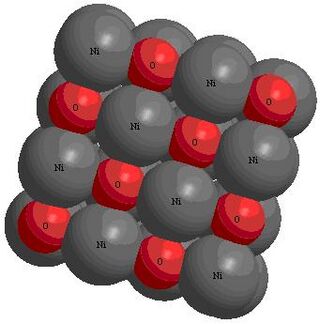
El NiO tiene una estructura similar a la de la sal común (NaCl). En esta estructura, los iones de níquel (Ni²⁺) y los iones de oxígeno (O²⁻) se organizan en posiciones específicas. Esta forma se conoce como sistema cúbico.
¿Por qué el NiO puede cambiar de color?
Al igual que muchos otros óxidos de metales, el NiO a veces no tiene una proporción exacta de 1:1 entre níquel y oxígeno. Cuando la proporción es perfecta, el NiO es de color verde. Si la proporción se desvía un poco, el NiO puede volverse negro.
Usos y reacciones del óxido de níquel(II)
El óxido de níquel(II) tiene muchos usos especiales. Se distingue entre el NiO de "calidad química", que es muy puro para usos específicos, y el de "calidad metalúrgica", que se usa para fabricar aleaciones.
Aplicaciones importantes
- Se utiliza en la industria de la cerámica para crear fritas, ferritas y esmaltes para porcelana.
- El óxido de níquel calentado (sinterizado) se usa para producir aleaciones de acero con níquel. Un ejemplo famoso es el invar, una aleación que casi no cambia de tamaño con la temperatura.
- Fue un componente importante de las baterías de níquel-hierro, también conocidas como baterías Edison.
- Es parte de las pilas de combustible.
- Es el punto de partida para fabricar muchas sales de níquel que se usan en química y como catalizadores (sustancias que aceleran reacciones químicas).
- Más recientemente, el NiO se usó en las baterías recargables de NiCd (níquel-cadmio), antes de que se desarrollaran las baterías de NiMH (níquel-hidruro metálico), que son mejores para el medio ambiente.
- El NiO es un material que cambia de color con la electricidad (electrocrómico). Se ha estudiado para usarlo en dispositivos que cambian de color, como ventanas inteligentes.
Reacciones químicas
- Cada año se producen unas 4000 toneladas de NiO de calidad química. Este NiO negro se usa para hacer sales de níquel al reaccionar con ácidos.
- El NiO es un catalizador muy útil para la hidrogenación (añadir hidrógeno a otras sustancias).
- Si se calienta óxido de níquel con hidrógeno, carbono o monóxido de carbono, se convierte en níquel metálico.
- A altas temperaturas (más de 700 °C), se combina con óxidos de sodio y potasio para formar compuestos llamados niquelatos.
- El óxido de níquel reacciona con el óxido de cromo(III) en un ambiente húmedo y básico para formar cromato de níquel.
¿Es seguro el óxido de níquel(II)?
La exposición prolongada al óxido de níquel(II) puede afectar los pulmones. Se ha observado que puede causar problemas respiratorios.
El óxido de níquel(II) permanece en el cuerpo por un tiempo largo. Estudios han mostrado que puede quedarse en los pulmones por más de 3 meses. Debido a esto, el óxido de níquel se clasifica como una sustancia que puede causar ciertos problemas de salud en humanos, basándose en estudios realizados en trabajadores de refinerías.
Galería de imágenes
Véase también
 En inglés: Nickel(II) oxide Facts for Kids
En inglés: Nickel(II) oxide Facts for Kids


