Óxido de manganeso(II) para niños
El óxido de manganeso(II) es un compuesto inorgánico con la fórmula química MnO. Se presenta como cristales de color verde y no tiene olor. Es el óxido iónico más sencillo que existe. Aunque se considera una base fuerte, cuando se disuelve no es corrosivo y no daña la piel. En la naturaleza, se puede encontrar como un mineral poco común llamado manganosita.
Datos para niños
Óxido de manganeso(II) |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Fórmula molecular | MnO | |
| Identificadores | ||
| Número CAS | 1344-43-0 | |
| Número RTECS | OP0900000 | |
| PubChem | 14940 | |
|
InChI
InChI=InChI=1S/Mn.O
Key: VASIZKWUTCETSD-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | cristales verdes | |
| Masa molar | 70,937 g/mol | |
| Punto de fusión | 1945 °C (2218 K) | |
| Índice de refracción (nD) | 2.16 | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble; soluble en ácido. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
¿Qué es el Óxido de Manganeso(II)?
El óxido de manganeso(II) es un compuesto químico que combina manganeso y oxígeno. Su fórmula, MnO, nos dice que tiene un átomo de manganeso por cada átomo de oxígeno. Es un material que se usa en muchas industrias.
¿Cómo se comporta químicamente?
El óxido de manganeso(II) es una base fuerte. Esto significa que puede reaccionar con ácidos. Cuando se disuelve en agua, sus partículas se unen con el agua. Esto hace que la solución sea casi neutra.
¿Cómo es su estructura?
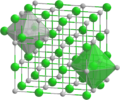
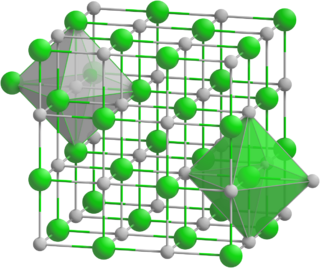
El MnO tiene una estructura similar a la de la sal de mesa (NaCl). En esta estructura, los átomos de manganeso y oxígeno se organizan de una forma especial. Cada átomo está rodeado por seis átomos del otro tipo. Esta organización forma una red cristalina.
El MnO es especial porque fue uno de los primeros compuestos cuya estructura magnética se estudió. Esto se hizo usando una técnica llamada difracción de neutrones en 1951. Este estudio mostró cómo los iones de manganeso se alinean magnéticamente.
¿Qué reacciones químicas tiene?
Cuando el óxido de manganeso(II) se mezcla con un ácido, forma una sal de manganeso y agua. Por ejemplo, si lo combinas con un ácido, obtendrás una nueva sustancia. Si se expone al oxígeno, puede transformarse en dióxido de manganeso.
¿Cómo se obtiene el Óxido de Manganeso(II)?
El MnO se puede obtener de varias maneras. Una forma es reducir otros óxidos de manganeso. Esto se hace usando hidrógeno o monóxido de carbono.
Métodos de preparación
- Reducción de óxidos superiores: Se puede calentar dióxido de manganeso (MnO2) con hidrógeno. La reacción es:
-
- MnO2 + H2 → MnO + H2O
- Uso comercial: A nivel industrial, se produce reduciendo MnO2 con gases como hidrógeno, monóxido de carbono o metano.
- Calentamiento de carbonato de manganeso: Otra forma es calentar carbonato de manganeso (MnCO3). Este proceso debe hacerse sin oxígeno para evitar que se forme otro tipo de óxido de manganeso. La reacción es:
-
- MnCO3 → MnO + CO2
¿Para qué se usa el Óxido de Manganeso(II)?
El óxido de manganeso(II) tiene muchos usos importantes en la industria y la agricultura.
Usos principales
- Fertilizantes y alimentos: Se utiliza en fertilizantes para ayudar a las plantas a crecer. También se añade a algunos alimentos para animales. Cada año se usan miles de toneladas para estos fines.
- Otros usos:
- Se usa como catalizador en la fabricación de ciertos alcoholes.
- Es un ingrediente en la producción de cerámicas.
- Se emplea en la fabricación de pinturas y vidrio de colores.
- Ayuda a blanquear grasas y aceites.
- Se usa en la impresión de telas.
Galería de imágenes
Véase también
 En inglés: Manganese(II) oxide Facts for Kids
En inglés: Manganese(II) oxide Facts for Kids