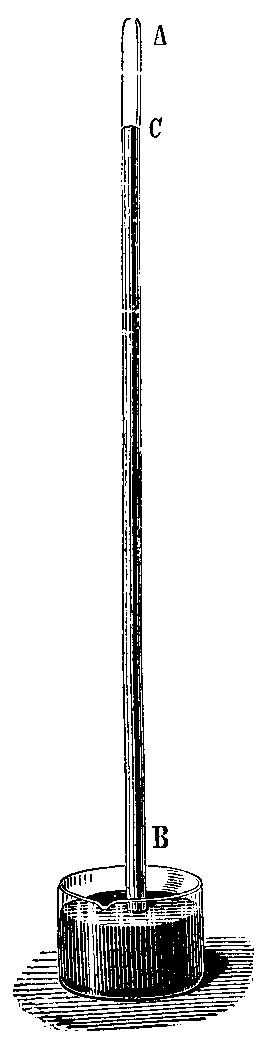Vacío para niños
El vacío es un espacio donde casi no hay materia, como el aire o cualquier otra cosa. Imagina un lugar tan, tan vacío que apenas hay partículas flotando. También usamos la palabra "vacío" para describir un recipiente que no tiene nada dentro, o un lugar donde la presión del aire es mucho más baja que la que sentimos normalmente.
El vacío puede existir de forma natural, como en el espacio exterior, o podemos crearlo artificialmente para usarlo en tecnología, ciencia o en nuestra vida diaria. Se utiliza en muchas industrias, como la de alimentos, la automotriz o la farmacéutica.
La "calidad" de un vacío se refiere a qué tan cerca está de ser un vacío perfecto. Cuanto menor sea la presión del gas en un espacio, mayor será la calidad del vacío. Por ejemplo, una aspiradora común reduce la presión del aire en un 20%. Pero existen vacíos de mucha mejor calidad. Las cámaras de ultravacío, que se usan en ciencia, pueden tener una presión mil millones de veces menor que la atmosférica. El espacio exterior es un vacío aún mejor, con solo unos pocos átomos de hidrógeno por cada metro cúbico en el espacio entre galaxias.
El vacío ha sido un tema de debate para los pensadores desde la antigua Grecia. Sin embargo, no se estudió de forma práctica hasta el siglo XVII. Fue Evangelista Torricelli quien creó el primer vacío en un laboratorio en 1643. Sus ideas sobre la presión atmosférica llevaron a nuevas formas de experimentar con el vacío. Un vacío torricelliano se hace llenando un tubo de vidrio largo con mercurio y luego invirtiéndolo en un recipiente con más mercurio.
El vacío se volvió muy importante para la industria en el siglo XX con la invención de las bombillas incandescentes y los tubos de vacío. Hoy en día, hay muchas tecnologías que usan el vacío. El desarrollo de los viajes espaciales también ha hecho que nos interese cómo el vacío afecta a los seres vivos.
Contenido
¿Qué significa "vacío" en la ciencia?
Según la «Sociedad Estadounidense del Vacío» (AVS), el término "vacío" se refiere a un espacio lleno de gases donde la presión total es menor que la presión atmosférica. Esto significa que cuanto más baja sea la presión del gas que queda, mayor será el grado de vacío. Por eso, podemos clasificar el vacío en diferentes niveles, desde un vacío bajo hasta uno muy alto.
¿De dónde viene la palabra "vacío"?
La palabra "vacío" viene del latín vacuus, que significa "vacío" o "nulo". Está relacionada con la palabra vacare, que significa "estar vacío".
¿Cómo se mide el vacío?
La presión atmosférica es la fuerza que el aire ejerce sobre la Tierra. A temperatura y presión normales, un metro cúbico de aire tiene muchísimas moléculas moviéndose muy rápido. Una forma de medir la presión atmosférica es con un barómetro de mercurio. Su valor se expresa en la altura de una columna de mercurio, que normalmente es de 760 milímetros. Por eso, una atmósfera estándar es igual a 760 mmHg. También se usa la unidad torricelli (Torr), donde 1 Torr es igual a 1 mmHg.
Medir presiones muy bajas
Para medir presiones muy bajas, se usan métodos especiales. Uno de ellos es el método de Pirani, que usa un sensor cuya resistencia eléctrica cambia según la cantidad de moléculas de gas presentes. A medida que el vacío es mejor (menos moléculas), el sensor se calienta más y su resistencia aumenta. Este cambio se mide para saber el nivel de vacío.
También existen medidores de ionización, que son muy precisos para medir vacíos extremadamente altos, donde la presión es increíblemente baja.
El aire que respiramos está compuesto principalmente por nitrógeno y oxígeno, pero también tiene pequeñas cantidades de otros gases como dióxido de carbono, argón, neón y vapor de agua.
¿Para qué se usa el vacío?
El vacío tiene muchas aplicaciones importantes:
- Para crear diferencias de presión: Se usa para levantar objetos, transportarlos (como en las aspiradoras) o para moldear materiales.
- Para eliminar gases: Es útil en la fabricación de bombillas, tubos electrónicos, para empaquetar alimentos y para detectar fugas.
- Para secar o deshidratar: Se usa para quitar el agua de productos, como en la liofilización (secado por congelación), o para desgasificar líquidos.
- Para aislar: El vacío es un excelente aislante térmico y eléctrico, lo que lo hace útil en termos y en la simulación de condiciones espaciales.
- Para evitar colisiones: En aparatos como los tubos de rayos catódicos (como los de las televisiones antiguas), microscopios electrónicos y aceleradores de partículas, el vacío permite que las partículas se muevan sin chocar con moléculas de aire.
- Para mantener superficies limpias: Ayuda a estudiar cómo se comportan los materiales en el espacio o en condiciones muy puras.
Breve historia del vacío
Durante mucho tiempo, la gente no sabía que el aire tenía peso y ejercía presión. En la antigua Grecia, había dos ideas principales: algunos pensaban que la materia estaba hecha de pequeñas partículas que se movían en un espacio vacío, mientras que otros, como Aristóteles, creían que la naturaleza "odiaba" el vacío y que no podía existir. Esta última idea fue la más aceptada durante la Edad Media.
A principios del siglo XVII, Galileo Galilei notó que las bombas de agua no podían subir el agua de los pozos más allá de unos 10 metros. Esto le intrigaba y compartió su curiosidad con sus alumnos.
En 1640, el italiano Gasparo Berti hizo un experimento que, sin saberlo, creó un vacío. Llenó un tubo largo con agua y lo invirtió en un recipiente, observando que el agua no se caía por completo, dejando un espacio vacío arriba.
Evangelista Torricelli, alumno de Galileo, entendió lo que estaba pasando. En 1644, diseñó un experimento usando mercurio en lugar de agua, porque el mercurio es mucho más denso. Así, creó el primer barómetro y demostró la existencia del vacío. El espacio vacío que se formaba en la parte superior del tubo de mercurio se llamó "vacío torricelliano".
La idea del vacío se aceptó aún más cuando, en 1648, Blaise Pascal llevó un barómetro de mercurio a la cima de una montaña. Observó que el nivel de mercurio en el tubo bajaba a mayor altura. Esto demostró que la presión del aire disminuye a medida que subimos, y que esta presión es la que sostiene la columna de mercurio. Así, se confirmó la existencia del vacío y la presión atmosférica.
Tipos de sistemas de vacío
La presión y la composición de los gases que quedan en un sistema de vacío cambian mucho según cómo se diseñe y se use. Para algunas aplicaciones, tener miles de millones de moléculas de gas por centímetro cúbico es aceptable. Pero en otros casos, se necesita un vacío mucho más "limpio", con solo unas pocas miles de moléculas.
El vacío se clasifica en diferentes rangos según la presión:
| Rango de Vacío | Presión en hPa (mbar) | Presión en mmHg (Torr) | Moléculas / cm³ | Camino libre medio |
|---|---|---|---|---|
| Presión ambiental | 1013 | 759.8 | 2.7 × 1019 | 68 nm |
| Bajo Vacío | 300 – 1 | 225 – 0.75 | 1019 – 1016 | 0.1 – 100 μm |
| Medio Vacío | 1 – 10−3 | 0.75 – 7.5 × 10−4 | 1016 – 1013 | 0.1 – 100 mm |
| Alto Vacío | 10−3 – 10−7 | 7.5 × 10−4 – 7.5 × 10−8 | 1013 – 109 | 10 cm – 1 km |
| Ultra Alto Vacío | 10−7 – 10−12 | 7.5 × 10−8 – 7.5 × 10−13 | 109 – 104 | 1 km – 105 km |
| Vacío Extremadamente Alto | <10−12 | <7.5 × 10−13 | <104 | >105 km |
La composición del gas que queda en un sistema de vacío cambia a medida que se extrae el aire, porque las bombas de vacío no son igual de eficientes para todos los gases. Al principio, la mayor parte del gas que sale de las paredes del recipiente es vapor de agua y dióxido de carbono. A presiones muy bajas, si el recipiente ha sido calentado, el gas principal que queda es hidrógeno.
Galería de imágenes
Véase también
 En inglés: Vacuum Facts for Kids
En inglés: Vacuum Facts for Kids
- Bomba de vacío
- Camino libre medio
- Hemisferios de Magdeburgo
- Vacío cuántico