Sulfato de níquel(II) para niños
Datos para niños
Sulfato de níquel(II) |
||
|---|---|---|
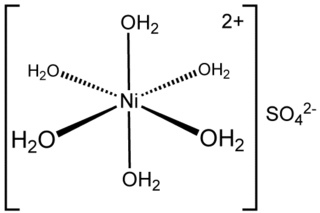 Estructura del sulfato de níquel hidratado
|
||
| Nombre IUPAC | ||
| Tetraoxosulfato(VI) de níquel(II) | ||
| General | ||
| Otros nombres | Sulfato de níquel(II) Sulfato de níquel |
|
| Fórmula molecular | NiSO4 | |
| Identificadores | ||
| Número CAS | 7786-81-4 | |
| Número RTECS | QR9350000 | |
| ChEBI | 53001 | |
| ChemSpider | 22989 | |
| DrugBank | DB14180 | |
| PubChem | 24586 | |
| UNII | 4FLT4T3WUN | |
|
InChI
InChI=InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2
Key: LGQLOGILCSXPEA-UHFFFAOYSA-L |
||
| Propiedades físicas | ||
| Densidad | 4010 kg/m³; 4,01 g/cm³ | |
| Masa molar | 153,887 g/mol | |
| Punto de ebullición | 840 °C (1113 K) | |
| Peligrosidad | ||
| NFPA 704 |
0
3
0
|
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El sulfato de níquel es un compuesto inorgánico, lo que significa que no está hecho de carbono e hidrógeno como los seres vivos. Su fórmula es NiSO4. También existe una forma que contiene agua, llamada hidratada, con la fórmula NiSO4(H2O)6. Es una sal de color azul que se disuelve muy bien en agua. Está formada por dos partes: el anión sulfato y el catión níquel, que tiene una carga eléctrica de +2. Es muy importante porque es la principal fuente del ion Ni+2 que se usa en el proceso de galvanizado.
Contenido
¿Para qué se usa el Sulfato de Níquel?
El sulfato de níquel se produce en grandes cantidades. Por ejemplo, en el año 2005 se fabricaron unas 40.000 toneladas. Su uso principal es en el galvanizado de níquel.
¿Qué es el Galvanizado?
El galvanizado es un proceso químico. Se usa para cubrir objetos con una capa delgada de níquel. Esto ayuda a protegerlos de la corrosión y les da un acabado brillante.
Diferentes formas del Sulfato de Níquel
Existen al menos siete tipos de sales de sulfato de níquel. Estas sales se distinguen por la cantidad de agua que contienen o por cómo están organizadas sus estructuras cristalinas.
¿Cómo se ve y qué propiedades tiene?
- La forma más común que contiene agua se llama hexahidrato. Se forma en soluciones de agua a temperaturas específicas.
- Si la temperatura es más baja, se forma un heptahidrato. Si es más alta, se forma otro tipo de hexahidrato.
- La forma que no tiene agua, llamada anhidra (NiSO4), es de color amarillo.
- Esta forma anhidra se descompone en Óxido de níquel(II) (NiO) a temperaturas muy altas, por encima de los 640 °C.
- Para obtener la forma anhidra, se calientan las formas con agua a más de 330 °C.
¿Cómo es su estructura interna?
Los estudios con cristalografía de rayos X muestran que el sulfato de níquel con seis moléculas de agua (NiSO4·6H2O) está formado por iones de níquel rodeados por seis moléculas de agua. Estos iones se unen a los iones sulfato mediante enlaces de hidrógeno. Cuando la sal se disuelve en agua, se forman soluciones que contienen estos iones de níquel con agua.
Todos los sulfatos de níquel son paramagnéticos. Esto significa que son atraídos débilmente por un campo magnético.
Véase también
 En inglés: Nickel(II) sulfate Facts for Kids
En inglés: Nickel(II) sulfate Facts for Kids


