Pentafluoruro de fósforo para niños
Datos para niños
Pentafluoruro de fósforo |
||
|---|---|---|
 |
||
| Nombre IUPAC | ||
| Pentafluoruro de fósforo | ||
| General | ||
| Fórmula molecular | PF5 | |
| Identificadores | ||
| Número CAS | 7647-19-0 | |
|
InChI
InChI=InChI=1S/F5P/c1-6(2,3,4)5
Key: OBCUTHMOOONNBS-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 5527 kg/m³; 5,527 g/cm³ | |
| Masa molar | 125,966 g/mol | |
| Punto de fusión | −93,78 °C (179 K) | |
| Punto de ebullición | −84,6 °C (189 K) | |
| Peligrosidad | ||
| Frases R | R26 R35 | |
| Frases S | S9 S26 S36/37/39 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El pentafluoruro de fósforo (también conocido como fluoruro de fósforo (V)) es un compuesto químico. Está formado por los elementos fósforo y flúor, y su fórmula es PF5. Pertenece a una familia de compuestos llamados haluros de fósforo.
En condiciones normales, es un gas sin color, con un olor fuerte y no se quema. Es importante saber que es un gas que puede ser muy dañino si se inhala. Si entra en contacto con aire húmedo o agua, reacciona de forma muy fuerte, creando fluoruro de hidrógeno (HF) y ácido fosfórico (H3PO4). El pentafluoruro de fósforo se usa a veces como un catalizador en procesos químicos para crear polímeros.
Contenido
Historia del Pentafluoruro de Fósforo
¿Quién descubrió el PF5?
El pentafluoruro de fósforo fue descubierto y descrito por primera vez en el año 1876. El científico británico que lo encontró fue Thomas Edward Thorpe (1845-1925).
¿Cómo se obtiene el Pentafluoruro de Fósforo?
Métodos de preparación del PF5
El pentafluoruro de fósforo se puede obtener de varias maneras en un laboratorio. Una forma es haciendo reaccionar pentacloruro de fósforo (PCl5) con trifluoruro de arsénico (AsF3). En esta reacción, se forma pentafluoruro de fósforo en forma de gas y tricloruro de arsénico (AsCl3) en estado líquido.
La reacción se ve así:
También se puede obtener haciendo reaccionar directamente el fósforo rojo con gas flúor a una temperatura baja.
Otra forma de conseguir PF5 es calentando ciertos compuestos como el NaPF6 o el Ba(PF6)2.
Estructura del Pentafluoruro de Fósforo
¿Cómo se organizan los átomos en el PF5?
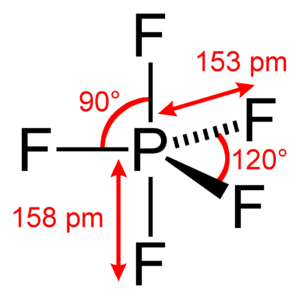
Las moléculas de pentafluoruro de fósforo tienen una forma especial llamada bipiramidal trigonal. Imagina una pirámide con una base triangular y otra pirámide igual pegada por la base, pero invertida. El átomo de fósforo está en el centro. Los cinco átomos de flúor se unen a él: tres están en la base triangular (posiciones ecuatoriales) y dos están en los vértices de las pirámides (posiciones axiales o apicales).
Los enlaces entre el flúor y el fósforo forman ángulos de 120 grados en la parte ecuatorial. Los dos enlaces a los átomos de flúor axiales son perpendiculares a la base.
¿Por qué los átomos de flúor parecen iguales?
Aunque la forma de la molécula sugiere que hay dos tipos de átomos de flúor (axiales y ecuatoriales), cuando se estudian con una técnica llamada RMN, todos los átomos de flúor parecen ser iguales. Esto ocurre porque los átomos de flúor cambian de posición muy rápidamente dentro de la molécula. Este movimiento es tan veloz que los instrumentos no pueden distinguirlos por separado, y lo que se ve es un promedio. Este fenómeno se conoce como el mecanismo de Berry.
Propiedades del Pentafluoruro de Fósforo
Propiedades físicas del PF5
El pentafluoruro de fósforo es un gas sin color a temperatura ambiente. Es aproximadamente 4.5 veces más pesado que el aire.
Cuando se enfría por debajo de su punto de fusión, que es de -93.8 °C, el pentafluoruro de fósforo se convierte en un sólido con una estructura cristalina hexagonal.
Propiedades químicas del PF5
El pentafluoruro de fósforo se descompone si se calienta mucho, separándose en otros compuestos.
Es muy sensible al agua. Si entra en contacto con aire húmedo o agua, se descompone rápidamente en una reacción fuerte. Esto forma fluoruro de hidrógeno (HF) y ácido fosfórico (H3PO4).
Debido a la formación de HF, el pentafluoruro de fósforo puede incluso dañar superficies de vidrio si entra en contacto con agua.
Cuando reacciona con vapor de agua, la reacción es un poco diferente:
También reacciona con óxido de silicio si está caliente.
El pentafluoruro de fósforo puede reaccionar con sustancias llamadas álcalis:
Además, puede reaccionar con fluoruros de metales (como sodio, potasio, etc.) para formar compuestos llamados hexafluorofosfatos.
Seguridad al manejar Pentafluoruro de Fósforo
¿Es peligroso el PF5?
El pentafluoruro de fósforo es un gas que se puede comprar para usos específicos. Es muy importante saber que es un gas que puede ser muy dañino. Puede causar quemaduras graves si entra en contacto con la piel, los ojos o las membranas mucosas (como las de la nariz o la boca).
Como mencionamos, reacciona de forma fuerte con el agua, liberando fluoruro de hidrógeno, que es un gas dañino y corrosivo. No hay información que indique que este compuesto cause cáncer. Tampoco hay muchos datos sobre cómo afecta al medio ambiente. Por estas razones, debe ser manejado con mucho cuidado y por personas expertas.
Véase también
 En inglés: Phosphorus pentafluoride Facts for Kids
En inglés: Phosphorus pentafluoride Facts for Kids



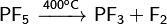



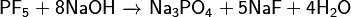
![\mathsf{PF_5 + NaF \ \xrightarrow{T}\ Na[PF_6] }](/images/math/6/3/0/630d1cdf456083d56895ad05ccff69c8.png)