Par solitario para niños
Un par solitario o par de electrones no compartidos es un par de electrones de valencia que no forma parte de un enlace químico ni se comparte con otros átomos. Cuando los átomos se unen para formar una molécula, sus electrones más externos, llamados electrones de valencia, pasan a ser parte de la molécula. Los pares solitarios son, en realidad, un grupo de estos electrones de valencia que pertenecen a la molécula.
Puedes identificar un par solitario si analizas los electrones más externos de un átomo. Un par solitario es un par de electrones que están juntos, pero que no se usan para formar un enlace. Esto los diferencia de los electrones "solitarios" (desapareados) que suelen estar solos en sus espacios.
El número total de electrones de valencia en una molécula es la suma de los electrones que forman enlaces y los electrones que forman pares solitarios.
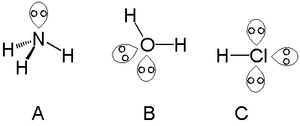
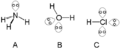
Los átomos que suelen tener pares solitarios al formar moléculas se encuentran en la parte derecha de la tabla periódica, especialmente en la esquina superior. Por ejemplo, los átomos del grupo del nitrógeno (como en el amoníaco) suelen tener un par solitario. Los átomos del grupo del oxígeno (como en el agua) pueden tener dos pares solitarios. Y los átomos del grupo del flúor (como en el ácido clorhídrico) pueden tener tres pares solitarios.
Contenido
¿Cómo afectan los pares solitarios la forma y polaridad de las moléculas?
Los pares solitarios a menudo hacen que una molécula (o una parte de ella) sea polar. Esto sucede porque un par solitario es una gran concentración de carga negativa muy cerca del centro del átomo. Esta carga negativa empuja fuertemente a los electrones que están formando enlaces, haciendo que esos enlaces se acerquen entre sí.
Como resultado, los ángulos entre los enlaces se hacen más pequeños. Esto crea una forma asimétrica en la molécula. La combinación de una forma asimétrica y una distribución desigual de la carga es lo que causa la polaridad.
Ejemplos de moléculas y sus formas
Podemos ver esto claramente al comparar el dióxido de carbono y el agua.
Dióxido de carbono (CO2)
En el dióxido de carbono, los cuatro electrones de valencia del carbono se usan para formar enlaces con dos átomos de oxígeno. Aquí, las únicas fuerzas que se repelen son las de los electrones de los enlaces. Por eso, los enlaces O=C=O se separan lo más posible. La molécula de dióxido de carbono es lineal, con un ángulo de 180° entre los enlaces, y no es polar.
Agua (H2O)
En el agua, el oxígeno tiene seis electrones de valencia. Solo dos se usan para formar enlaces con el hidrógeno. Los otros cuatro electrones forman dos pares solitarios. Estos pares solitarios cambian el ángulo de enlace H-O-H. La molécula de agua no es lineal y es polar. El ángulo H-O-H es de 104,5°, no de 180°. La repulsión de los dos pares solitarios hace que los átomos de hidrógeno se acerquen. Esto es un buen ejemplo de cómo la teoría de repulsión de pares de electrones de la capa de valencia (TRPECV) nos ayuda a entender la forma de las moléculas.
Pares solitarios y la formación de nuevos enlaces
Los pares solitarios dan a las moléculas características especiales. Estos pares de electrones no compartidos pueden usarse para formar enlaces covalentes coordinados (también llamados dativos) con otras moléculas. Esto significa que las moléculas con pares solitarios pueden actuar como "nucleófilos". Un nucleófilo es una sustancia que tiene muchos electrones y puede "atacar" zonas con carga positiva en otras moléculas para formar nuevos enlaces.
También podemos decir que las moléculas con pares solitarios pueden actuar como bases de Lewis. Una base de Lewis es una sustancia que puede donar un par de electrones. Estas bases de Lewis pueden reaccionar con otras moléculas (o átomos) que tienen espacios vacíos para electrones, formando nuevas estructuras.
Un ejemplo sencillo es la formación del ion hidronio (H3O+). Este ion se forma cuando se disuelven ácidos en agua. El átomo de oxígeno del agua usa uno de sus pares solitarios para unirse al ion hidrógeno (H+) que libera el ácido. Así, el oxígeno actúa como nucleófilo y como base de Lewis.
Pares solitarios especiales
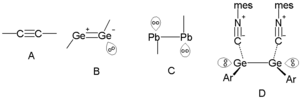
Algunos iones, como los de plomo y estaño, pueden tener un par solitario que afecta su forma, aunque no se esperaría por su configuración electrónica normal. Este efecto puede causar que las estructuras de algunos compuestos de plomo y estaño se distorsionen.
Se ha estudiado que el par solitario del plomo podría estar relacionado con su capacidad para afectar el cuerpo. Cuando los iones de plomo entran en el cuerpo, pueden reemplazar a otros iones metálicos importantes en algunas proteínas. Esto puede cambiar la forma de la proteína y hacer que no funcione correctamente. Por ejemplo, el plomo puede afectar una enzima llamada porfobilinógeno sintetasa, que es importante para el cuerpo. Al cambiar su forma, la enzima no puede hacer su trabajo, lo que puede causar problemas.
Los pares solitarios de los átomos del grupo 14 también se ven en los enlaces triples. Por ejemplo, los alquinos tienen un enlace triple con un ángulo de 180°. Pero en elementos más pesados del mismo grupo, como el germanio o el plomo, los enlaces triples pueden tener un par de electrones no enlazantes y una forma diferente. En los compuestos de plomo, cada átomo puede tener un par de electrones solitarios.
Galería de imágenes
Véase también
 En inglés: Lone pair Facts for Kids
En inglés: Lone pair Facts for Kids