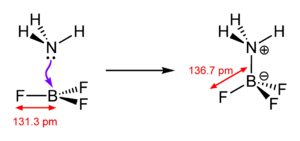Teoría ácido-base de Lewis para niños
Datos para niños Ácidos y Bases |
|
|---|---|
 |
|
| Ácidos y Bases | |
|
|
| Tipos de ácidos | |
|
|
| Tipos de bases | |
En química, un ácido de Lewis es una sustancia que puede aceptar un par de electrones de otra sustancia. Imagina que tiene un "espacio vacío" en su estructura donde puede recibir esos electrones. Por otro lado, una base de Lewis es una sustancia que tiene un par de electrones "libres" que puede donar o compartir. Piensa que tiene electrones extra para ofrecer.
Cuando un ácido de Lewis y una base de Lewis se encuentran, la base de Lewis dona su par de electrones al ácido de Lewis. Esto forma un nuevo enlace químico llamado enlace dativo y la nueva molécula que se crea se llama aducto de Lewis.
Por ejemplo, el amoníaco (NH3) es una base de Lewis porque tiene un par de electrones que no están formando enlaces y puede donarlos. El trimetilborano (Me3B) es un ácido de Lewis porque tiene un espacio vacío para aceptar un par de electrones. Cuando reaccionan, forman un aducto donde el amoníaco comparte sus electrones con el trimetilborano.
Estos conceptos fueron propuestos por el científico Gilbert N. Lewis. Los términos nucleófilo y electrófilo son similares a base de Lewis y ácido de Lewis, pero se enfocan más en la velocidad de las reacciones, mientras que los términos de Lewis se centran en la formación de los aductos.
Contenido
¿Cómo se representan los aductos de Lewis?
Para mostrar cómo una base de Lewis dona electrones a un ácido de Lewis, a menudo se usa una flecha que va desde la base (la que dona) hacia el ácido (el que acepta). Por ejemplo, Me3B ← NH3.
También se puede usar un punto central para representar el aducto, como Me3B • NH3. Otro ejemplo es el dietil eterato de trifluoruro de boro, BF3 • Et2O. Este punto indica que las dos moléculas están unidas por un enlace dativo.
¿Qué son los ácidos de Lewis?
Los ácidos de Lewis son muy variados. En general, son sustancias que tienen un orbital vacío donde pueden aceptar un par de electrones. Algunos ejemplos comunes incluyen:
- El protón (H+), que es un átomo de hidrógeno sin su electrón.
- Ciertos iones de metales, como el Fe3+ o el Mg2+.
- Sustancias con una forma plana triangular, como el BF3.
- Algunos compuestos de fósforo, arsénico y antimonio.
Algunos ácidos de Lewis son "simples" y reaccionan directamente con una base de Lewis. Por ejemplo, el trifluoruro de boro (BF3) puede aceptar un ion fluoruro (F-) para formar BF4-.
Otros ácidos de Lewis son más "complejos" y necesitan un paso previo antes de poder unirse a una base. Por ejemplo, los trihaluros de aluminio (como AlCl3) suelen estar unidos en grupos más grandes y necesitan separarse para reaccionar.
El protón (H+) como ácido de Lewis
El protón (H+) es un ácido de Lewis muy importante. Aunque en realidad no existe solo en una solución (siempre está unido a otras moléculas, como el agua), se considera que acepta un par de electrones.
- H+ + NH3 → NH4+ (el amoníaco dona electrones al protón)
- H+ + OH- → H2O (el ion hidróxido dona electrones al protón)
¿Para qué se usan los ácidos de Lewis?
Los ácidos de Lewis son muy útiles en la química. Se usan como catalizadores en muchas reacciones. Un catalizador es una sustancia que acelera una reacción química sin consumirse en ella. Por ejemplo, en una reacción llamada alquilación de Friedel-Crafts, el AlCl3 actúa como un ácido de Lewis para ayudar a formar nuevas moléculas.
¿Qué son las bases de Lewis?
Una base de Lewis es una sustancia que tiene un par de electrones disponibles para donar. Estos electrones se encuentran en un orbital molecular que está lleno. Las bases de Lewis más comunes incluyen:
- Aminas: Como el amoníaco (NH3) y otras moléculas similares que contienen nitrógeno.
- Fosfinas: Compuestos que contienen fósforo.
- Compuestos que contienen oxígeno, azufre, selenio y teluro, como el agua (H2O), los éteres y las cetonas.
- Aniones: Iones con carga negativa, como el ion hidruro (H-) o el ion fluoruro (F-).
- Moléculas con enlaces dobles o triples que tienen muchos electrones, como el eteno o el benceno.
La fuerza de una base de Lewis se relaciona con qué tan fácilmente puede donar su par de electrones.
¿Para qué se usan las bases de Lewis?
Las bases de Lewis son muy importantes en la química, especialmente en la catálisis. Muchas bases de Lewis se unen a metales de transición para formar ligandos. Estos ligandos pueden modificar la forma en que funcionan los catalizadores metálicos, haciéndolos más eficientes o selectivos para producir ciertos productos.
Algunas bases de Lewis son "multidentadas", lo que significa que pueden formar varios enlaces con un mismo ácido de Lewis. Estas se llaman agentes quelantes. Imagina que son como una pinza que puede agarrar un ion metálico en varios puntos, formando una estructura muy estable.
Clasificación de ácidos y bases: duros y blandos
Los ácidos y bases de Lewis también se pueden clasificar como "duros" o "blandos".
- Un ácido o base duro es pequeño y sus electrones no se mueven fácilmente.
- Un ácido o base blando es más grande y sus electrones se pueden mover o "polarizar" más fácilmente.
Ejemplos:
- Ácidos duros típicos: H+, iones de metales alcalinos (como Na+), boranos.
- Ácidos blandos típicos: Ag+, algunos metales en estado de oxidación cero.
- Bases duras típicas: Amoníaco, agua, ion fluoruro.
- Bases blandas típicas: Fosfinas, tioéteres, ion yoduro.
La regla general es que las interacciones más fuertes ocurren entre un ácido duro y una base dura, o entre un ácido blando y una base blanda. Esto ayuda a predecir qué tan bien se unirán un ácido y una base.
Historia de los ácidos y bases de Lewis
El concepto de ácidos y bases de Lewis fue propuesto por Gilbert N. Lewis en 1923. Él observó que los enlaces químicos se forman cuando los átomos comparten pares de electrones. Si un átomo dona ambos electrones para el enlace, se llama enlace covalente dativo. Lewis sugirió que el átomo que dona el par de electrones es una base, y el que lo acepta es un ácido.
En el mismo año, se publicó la Teoría ácido-base de Brønsted-Lowry, que se enfoca en la transferencia de protones (H+). Ambas teorías son importantes y se complementan. Una base de Lewis casi siempre es también una base de Brønsted-Lowry (porque puede donar electrones a un protón), pero un ácido de Lewis no siempre es un ácido de Brønsted-Lowry.
Véase también
- Ácido
- Base (química)
- Reacción ácido-base
- Teoría ácido-base de Brønsted-Lowry
- Teoría ácido-base de Arrhenius