Núcleo atómico para niños
El núcleo atómico es la parte central de un átomo. Es muy pequeño, pero contiene casi toda la masa del átomo, más del 99.9%. Además, tiene una carga eléctrica positiva.
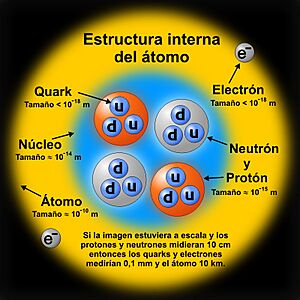
Está formado por partículas llamadas protones y neutrones, a las que en conjunto se les llama nucleones. Estas partículas se mantienen unidas por una fuerza muy poderosa, la interacción nuclear fuerte. Esta fuerza es tan fuerte que logra vencer la repulsión entre los protones, que tienen la misma carga positiva y normalmente se repelerían (como los polos iguales de dos imanes).
El número de protones en el núcleo es lo que define a un elemento químico. Por ejemplo, todos los átomos de oxígeno tienen el mismo número de protones. Sin embargo, los núcleos de un mismo elemento pueden tener diferente número de neutrones. A estos átomos con la misma cantidad de protones pero diferente cantidad de neutrones se les llama isótopos.
La idea de que existe un núcleo atómico surgió del famoso experimento de Rutherford. En este experimento, se lanzaron pequeñas partículas (llamadas partículas alfa, que son núcleos de helio) contra una lámina muy delgada de oro. La mayoría de las partículas atravesaron la lámina, pero algunas rebotaron. Esto demostró que el átomo tiene un centro muy pequeño y denso, al que llamamos núcleo.
Contenido
Historia del descubrimiento del núcleo atómico
Primeras ideas sobre el átomo
El descubrimiento de los electrones fue el primer indicio de que los átomos tenían una estructura interna. A principios del siglo XX, se pensaba que el átomo era como un "pudín de pasas", un modelo propuesto por J. J. Thomson. En este modelo, el átomo era una gran esfera de carga positiva con pequeños electrones negativos incrustados en ella.
En esa época, los científicos también descubrieron tres tipos de radiaciones que salían de los átomos: alfa, beta y radiación gamma. Los experimentos de Lise Meitner, Otto Hahn (en 1911) y James Chadwick (en 1914) mostraron que la radiación beta se emitía con una variedad de energías, lo que al principio parecía indicar que la energía no se conservaba. Más tarde, se descubrió que la energía sí se conservaba, gracias al descubrimiento de los neutrinos.
El experimento de Rutherford y el modelo nuclear
En 1906, Ernest Rutherford comenzó a investigar cómo las partículas alfa se movían a través de la materia. Sus colaboradores, Hans Geiger y Ernest Marsden, realizaron experimentos importantes.
En 1909, Rutherford, Geiger y Marsden llevaron a cabo un experimento clave. Dispararon partículas alfa (que son núcleos de helio) contra una lámina muy fina de oro. El modelo de Thomson predecía que las partículas alfa pasarían por la lámina con solo pequeñas desviaciones. Sin embargo, para sorpresa de todos, algunas partículas se desviaron mucho, e incluso algunas rebotaron completamente hacia atrás.
Este descubrimiento, en 1911, llevó a Rutherford a proponer un nuevo modelo atómico de Rutherford. En este modelo, el átomo tiene un núcleo central muy pequeño y denso con carga positiva, y los electrones giran alrededor de él. Así, la mayoría de las partículas alfa pasaban porque el átomo es mayormente espacio vacío, pero las que se acercaban al pequeño y denso núcleo rebotaban o se desviaban.
El problema del "cemento nuclear" y el neutrón
El modelo de Rutherford funcionó bien por un tiempo. Se pensaba que los electrones, al ser negativos, ayudaban a mantener unidos a los protones positivos en el núcleo, actuando como un "cemento nuclear". Sin embargo, estudios posteriores, como los de Franco Rasetti en 1929, mostraron que había un problema con el "espín" (una propiedad de las partículas) de algunos núcleos, como el nitrógeno-14. El modelo de Rutherford no podía explicarlo.
En 1930, Wolfgang Pauli sugirió que debía existir una tercera partícula en el núcleo, a la que llamó "neutrón". Propuso que era más ligera que un electrón, no tenía carga eléctrica y no interactuaba fácilmente con la materia, por lo que no se había detectado. Esta idea ayudó a resolver el problema de la energía en la desintegración beta y el espín del nitrógeno-14. Enrico Fermi renombró estas partículas como "neutrinos" (pequeño neutral en italiano) en 1931.
Finalmente, en 1932, James Chadwick descubrió el neutrón, una partícula sin carga que forma parte del núcleo. Ese mismo año, Dimitri Ivanenko sugirió que los neutrones eran partículas con espín 1/2 que existían en el núcleo, y que no había electrones dentro del núcleo. Francis Perrin también sugirió que los neutrinos eran partículas nucleares que se creaban durante la desintegración beta.
Después del descubrimiento del neutrón, Werner Heisenberg propuso que los neutrones podían ser parte del núcleo, y no los electrones. Esta teoría resolvió el problema del espín y explicó el comportamiento nuclear.
Sin embargo, surgió un nuevo problema: si los electrones no eran el "cemento nuclear", ¿qué mantenía unidos a los protones, que se repelen fuertemente entre sí? La fuerza de repulsión entre dos protones es enorme a las distancias tan pequeñas dentro del núcleo.
La fuerza nuclear fuerte y el pion
La solución a este problema llegó gradualmente. En 1927, Heisenberg propuso el principio de incertidumbre, que dice que no podemos conocer con total precisión la posición y la velocidad de una partícula al mismo tiempo.
En 1930, Albert Einstein dedujo, basándose en este principio, que también hay una incertidumbre en la medición de la energía de un sistema en un corto período de tiempo. Cuanto más corto sea el tiempo, menos precisa será la medición de la energía.
En 1932, Heisenberg sugirió que existía un campo de fuerza que unía los protones, gracias a la existencia muy breve de una partícula. Esta partícula solo podría existir por un instante debido al principio de incertidumbre de Einstein.
El físico japonés Hideki Yukawa analizó las propiedades de esta partícula en 1935. Describió que la partícula solo podría existir por un tiempo extremadamente corto (unos 5 x 10-24 segundos), justo el tiempo suficiente para viajar de un protón a otro dentro del núcleo. La energía necesaria para que esta partícula existiera por tan poco tiempo se ajustaba al principio de incertidumbre. Esta energía equivalía a una partícula con una masa 250 veces mayor que la del electrón.
Se hicieron muchos intentos para detectar esta partícula. Como solo existe por un instante y usa energía "prestada" por el principio de incertidumbre, sería imposible detectarla a menos que se le proporcionara esa energía. Los rayos cósmicos (partículas de alta energía que llegan del espacio) podían proporcionar esa energía. En 1948, Cecil Frank Powell detectó esta partícula, que fue llamada Pion, mientras experimentaba con rayos cósmicos en Bolivia.
Descripción del núcleo atómico
Forma y tamaño del núcleo
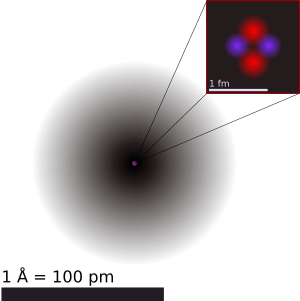
Los núcleos atómicos son muchísimo más pequeños que el átomo completo, entre 10,000 y 100,000 veces más pequeños. Sin embargo, contienen más del 99% de la masa del átomo, lo que significa que son increíblemente densos.
Los experimentos muestran que el núcleo se parece mucho a una esfera o un elipsoide compacto, con un tamaño de aproximadamente 10-15 metros (un femtómetro). La densidad dentro del núcleo es casi constante. El tamaño del núcleo varía según el número de protones y neutrones que contenga: los núcleos más pesados son un poco más grandes.
La densidad de carga eléctrica del núcleo es constante hasta cierta distancia y luego disminuye rápidamente. Aunque se aproximan a esferas, la mayoría de los núcleos no son perfectamente esféricos, lo que se puede ver en sus propiedades magnéticas.
Estabilidad del núcleo
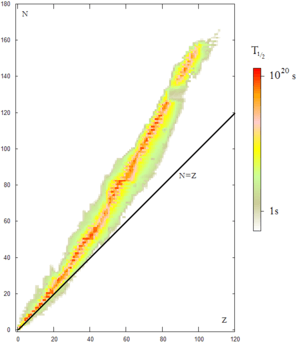
Los núcleos atómicos se comportan como partículas compuestas. La mayoría de los núcleos son estables si tienen un equilibrio entre el número de neutrones y protones. Sin embargo, los neutrones aislados y los núcleos con demasiados neutrones o protones son inestables o radiactivos.
La estabilidad de los núcleos se explica por la existencia de los piones. Fuera del núcleo, un neutrón puede desintegrarse en un protón, un electrón y un antineutrino. Pero dentro del núcleo, los neutrones y protones están tan cerca que intercambian piones constantemente. Esto hace que los neutrones se transformen en protones y viceversa muy rápidamente. Este intercambio continuo evita que los neutrones se desintegren, haciendo que los neutrones dentro de los núcleos sean mucho más estables que los neutrones aislados. Si el número de protones y neutrones se desequilibra, la desintegración se vuelve más probable.
Modelos de estructura del núcleo atómico
A lo largo de la historia, los científicos han propuesto diferentes modelos para entender la estructura del átomo y su núcleo:
- Modelo de Dalton (1808): El químico inglés John Dalton propuso que toda la materia está hecha de átomos indivisibles e invisibles. Para él, el núcleo atómico era desconocido.
- Modelo de Thomson (1897): Joseph John Thomson fue el primero en sugerir una estructura interna para el átomo. Identificó el electrón como una partícula negativa y propuso que el átomo era una esfera positiva con electrones incrustados, como un "pudín de pasas".
- Modelo de Rutherford (1911): Como ya vimos, Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden bombardearon láminas de metal con partículas alfa. Los resultados de su experimento mostraron que el átomo tiene un núcleo central muy pequeño y denso con carga positiva, donde se concentra la masa. Los electrones, con carga negativa, giran en órbitas muy alejadas del núcleo.
- Modelo de Bohr (1913): Niels Bohr mejoró el modelo de Rutherford. Postuló que los electrones giran en órbitas específicas alrededor del núcleo, cada una con un nivel de energía diferente. Los electrones pueden cambiar de nivel de energía absorbiendo o emitiendo energía (por ejemplo, en forma de luz).
Actualmente, existen dos modelos principales para describir el núcleo atómico:
- El modelo de la gota líquida
- El modelo de capas
Aunque al principio eran diferentes, los científicos A. Bohr y Mottelson crearon un modelo combinado que usa ideas de ambos.
Modelo de la gota líquida
Este modelo, propuesto por Niels Bohr en 1935, compara el núcleo con una gota de líquido. No busca describir la estructura interna compleja, sino cómo se unen los neutrones y protones y cómo se comportan los núcleos cuando están excitados.
Desde el punto de vista de la masa, se observa que la masa de un núcleo atómico es un poco menor que la suma de las masas de sus protones y neutrones individuales. Esta diferencia de masa se convierte en energía de unión, según la famosa ecuación de Einstein E = mc². Esta energía es lo que mantiene unidas a las partículas en el núcleo.
El modelo de la gota líquida intenta explicar esta energía de unión basándose en la forma y el tamaño del núcleo, como si fuera una gota. También interpreta los estados excitados de los núcleos como si la "gota" estuviera rotando o vibrando.
Modelo de capas
Este modelo busca explicar la estructura interna del núcleo, incluyendo su momento angular (una especie de giro) y por qué algunos núcleos son más estables que otros. Los núcleos con un "número mágico" de nucleones (2, 8, 20, 28, 50, 82 y 126) son especialmente estables.
El modelo de capas sugiere que los nucleones se agrupan en "capas", de manera similar a cómo los electrones se organizan en capas alrededor del núcleo. Cada capa tiene un conjunto de estados cuánticos con energías parecidas. Como los nucleones son fermiones (un tipo de partícula), llenan las capas de menor energía primero. Las capas no son como las capas de una cebolla, sino que se superponen en el espacio.
Galería de imágenes
Véase también
 En inglés: Atomic nucleus Facts for Kids
En inglés: Atomic nucleus Facts for Kids