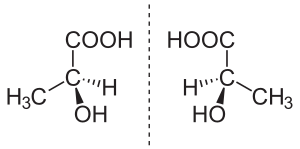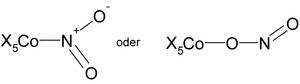Isomería para niños
La isomería es una propiedad fascinante de los compuestos químicos. Imagina que tienes un conjunto de piezas de construcción (átomos) y una cantidad específica de cada tipo. Con esas mismas piezas, puedes armar diferentes estructuras. Eso es lo que pasa con los isómeros: son moléculas que tienen exactamente los mismos tipos y cantidades de átomos, pero están conectados de maneras distintas o se organizan de forma diferente en el espacio.
Debido a estas diferencias en cómo se conectan o se organizan sus átomos, los isómeros tienen propiedades diferentes. Por ejemplo, el alcohol etílico (que se usa en desinfectantes) y el éter dimetílico (un gas que se usa como propelente) son isómeros. Ambos tienen la misma fórmula molecular, C2H6O, pero sus átomos están unidos de forma diferente, ¡y por eso son sustancias distintas!
Cuando un químico descubre una nueva sustancia, primero averigua qué elementos la forman y en qué proporción. Luego, determina el peso de la molécula para calcular su fórmula molecular, es decir, cuántos átomos de cada elemento tiene. Después de eso, el desafío es descubrir cómo esos átomos están conectados entre sí y cómo se organizan en el espacio. Aquí es donde la isomería se vuelve importante, porque a menudo hay varias formas posibles de organizar los mismos átomos, y cada una de esas formas es un isómero.
Aunque la isomería es muy común en la química orgánica (la química de los compuestos de carbono), también existe en algunos compuestos inorgánicos.
Contenido
- ¿Cómo se descubrió la isomería?
- Tipos de isomería
- Isomería en química inorgánica
- Isomerización: El cambio de una molécula a otra
- Véase también
¿Cómo se descubrió la isomería?
La isomería se observó por primera vez en 1827. Un científico llamado Friedrich Wöhler preparó una sustancia llamada cianato de plata. Se dio cuenta de que, aunque esta sustancia tenía los mismos elementos en las mismas proporciones que el fulminato de plata (preparado por Justus von Liebig un año antes), sus propiedades eran muy diferentes.
Este descubrimiento fue sorprendente porque en esa época se pensaba que los compuestos químicos solo podían ser diferentes si tenían elementos distintos o en proporciones diferentes. Después de más hallazgos similares, como el descubrimiento de Wöhler en 1828 de que la urea tenía la misma composición atómica que el cianato de amonio (que era químicamente diferente), el científico Jöns Jakob Berzelius propuso el término isomerismo en 1830 para describir este fenómeno.
En 1848, Louis Pasteur logró separar pequeños cristales de ácido tartárico en dos formas que eran como imágenes en un espejo. Las moléculas de cada forma eran estereoisómeros ópticos, y sus soluciones hacían girar la luz polarizada en la misma cantidad, pero en direcciones opuestas.
Tipos de isomería
Existen dos tipos principales de isomería: la estructural y la espacial.
Isomería estructural o constitucional
En este tipo de isomería, los compuestos tienen la misma fórmula molecular, pero la forma en que sus átomos están conectados entre sí es diferente. Es como tener las mismas piezas de LEGO, pero construir dos objetos completamente distintos con ellas.
Dentro de la isomería estructural, hay tres modos principales:
- Isomería de cadena o esqueleto: Los isómeros de este tipo tienen cadenas de carbono diferentes. Es decir, la forma principal de la molécula es distinta.
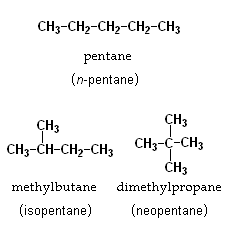
Por ejemplo, el pentano tiene varios isómeros de cadena, como el isopentano y el neopentano. Todos tienen 5 átomos de carbono y 12 de hidrógeno (C5H12), pero la forma en que esos carbonos se unen es diferente.
- Isomería de posición: En este caso, los grupos especiales de átomos (llamados grupos funcionales) están unidos en diferentes lugares de la cadena principal.
Un ejemplo es el pentanol, que tiene tres isómeros de posición: 1-pentanol, 2-pentanol y 3-pentanol. Todos tienen el mismo grupo funcional (-OH), pero este grupo se encuentra en diferentes carbonos de la cadena.
- Isomería de grupo funcional: Aquí, la forma en que los átomos se conectan crea diferentes tipos de grupos funcionales en la molécula. Esto significa que los isómeros pertenecen a diferentes familias de compuestos químicos.
Por ejemplo, el ciclohexano y el 1-hexeno tienen la misma fórmula molecular (C6H12). Sin embargo, el ciclohexano es un anillo de carbonos (un cicloalcano), mientras que el 1-hexeno es una cadena abierta con un doble enlace (un alqueno).
Isomería de cadena: ¿Cómo se organizan los carbonos?
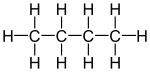
En la isomería de cadena, lo que cambia es la disposición de los átomos de carbono en la cadena principal. Esta cadena puede ser lineal o tener diferentes ramificaciones.
Por ejemplo, la fórmula C4H10 puede ser tanto el butano (una cadena lineal de 4 carbonos) como el metilpropano (una cadena de 3 carbonos con una ramificación de 1 carbono).
 |
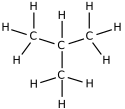 |
|---|---|
| Butano (n-butano) |
Metilpropano (isobutano) |
Para la fórmula C5H12, hay tres isómeros de cadena posibles: pentano, metilbutano (isopentano) y dimetilpropano (neopentano). El número de isómeros de cadena aumenta muy rápido a medida que el número de átomos de carbono crece.
Isomería de posición: ¿Dónde está el grupo especial?
Este tipo de isomería ocurre en compuestos que tienen la misma estructura de carbono, pero un grupo funcional o una cadena lateral se encuentra en una posición diferente.
Por ejemplo, la fórmula molecular C4H10O puede ser el 1-butanol o el 2-butanol. La diferencia es la posición del grupo -OH (hidroxilo): en el 1-butanol está en el primer carbono, y en el 2-butanol está en el segundo.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| 1-butanol | 2-butanol |
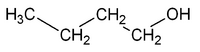 |
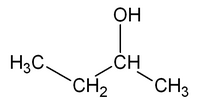 |
Si intentaras poner el grupo -OH en el carbono 3, seguirías obteniendo el 2-butanol, solo que visto desde el otro lado.
Isomería funcional: ¿Qué tipo de compuesto es?
En la isomería funcional, lo que cambia es el tipo de grupo funcional, aunque el esqueleto de carbono sea el mismo. Esto significa que los isómeros pertenecen a diferentes familias de compuestos químicos.
Por ejemplo, la fórmula C3H6O puede ser el propanal (que es un aldehído) o la propanona (que es una cetona).
| CH3-CH2-CHO | CH3-CO-CH3. |
|---|---|
| Propanal (un aldehído) | Propanona (una cetona) |
Otros ejemplos de compuestos que pueden presentar isomería funcional son los Alquenos y Cicloalcanos, los alcoholes y éteres, y los ácidos y ésteres.
Tautomería: Un cambio rápido de átomos
La tautomería es un tipo especial de isomería donde un átomo (generalmente hidrógeno) se mueve entre dos estructuras, y estas dos formas (llamadas tautómeros) pueden convertirse fácilmente una en la otra.
Un ejemplo es la tautomería ceto-enólica, donde una molécula con un grupo carbonilo (C=O, típico de las cetonas) puede transformarse en una molécula con un grupo -OH unido a un doble enlace (C=C).
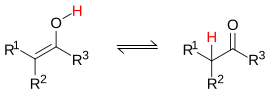 |
|---|
| Tautomería ceto-enólica. |
Isomería espacial o estereoisomería
En la isomería espacial, los compuestos tienen la misma fórmula molecular y sus átomos están conectados de la misma manera, pero su disposición en el espacio es diferente. Es como si tuvieras dos guantes, uno para la mano derecha y otro para la izquierda: son muy parecidos, pero no puedes superponerlos perfectamente.
Los estereoisómeros se ven iguales si los dibujas en un plano, pero necesitas verlos en 3D para notar las diferencias. Se dividen en dos tipos: isomería conformacional e isomería configuracional.
Isomería conformacional: Rotación de enlaces
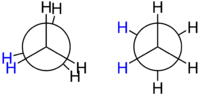
Los isómeros conformacionales, o confórmeros, pueden convertirse uno en otro simplemente girando alrededor de los enlaces simples entre los átomos de carbono. Esta rotación es bastante libre, incluso a temperaturas bajas.
Por lo general, estos isómeros no se pueden separar porque se interconvierten muy fácilmente. Se pueden visualizar bien usando las proyecciones de Newman.
| Proyecciones de Newmann para la molécula de etano. | Distintas conformaciones del etano por rotación. |
Otro ejemplo de isomería conformacional se ve en compuestos con anillos hexagonales, como el ciclohexano, que puede adoptar formas de "silla" o de "bote".
Isomería configuracional: Necesita más energía para cambiar
Para convertir un isómero configuracional en otro, no basta con una simple rotación; se necesita mucha energía, a menudo rompiendo y formando enlaces. Por eso, estos isómeros sí se pueden separar. Se dividen en: isomería geométrica (o cis-trans) e isomería óptica.
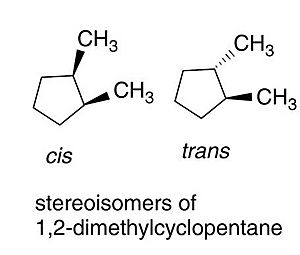
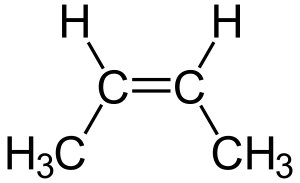
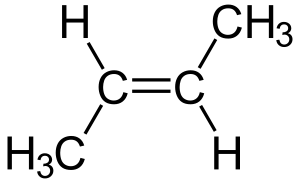
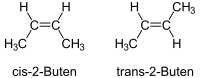
Isomería geométrica o cis-trans: Posición en el espacio
La isomería cis-trans se refiere a compuestos que tienen sus átomos conectados en el mismo orden, pero con una orientación tridimensional diferente. Se presenta en cicloalcanos (anillos de carbono) y en alquenos (cadenas de carbono con un doble enlace). Ocurre cuando hay dos grupos idénticos para comparar y se encuentran en diferentes posiciones.
- En los cicloalcanos: Se usa cis cuando los grupos funcionales están del mismo lado del anillo, y trans si están en lados opuestos.
- En los dobles enlaces: Se usa cis si los grupos están del mismo lado del doble enlace, y trans si están en lados opuestos.
Este tipo de isomería da propiedades físicas distintas a las moléculas, porque los dobles enlaces no pueden girar libremente como los enlaces simples.
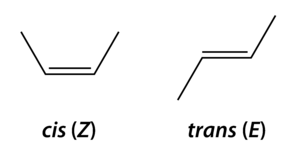
Las dos posibilidades se llaman:
- Forma cis (o forma Z): con los dos grupos más grandes del mismo lado.
- Forma trans (o forma E): con los dos grupos más grandes en posiciones opuestas.
Estas dos formas no pueden convertirse una en otra espontáneamente porque el doble enlace lo impide.
| Isómeros del But-2-eno | Ácido maleico (Cis) y ácido fumárico (trans) |
Formas trans (E) y cis (Z) del 1,2-dibromoeteno. |
|---|---|---|
 |
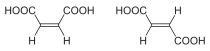 |
 |
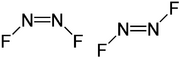
La isomería geométrica también se presenta en compuestos con doble enlace N=N o en compuestos cíclicos donde la rotación también está impedida.
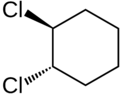
| 1,2-dimetilciclopentano (formas cis y trans) |
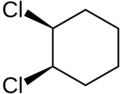
cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis y trans del difluorodiazeno |
|---|---|---|---|
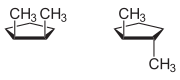 |
 |
 |
 |
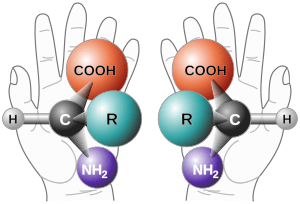
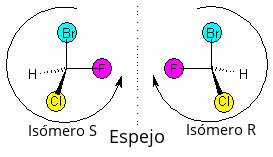
Isomería óptica o enantiomería: Como tus manos
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico (también llamado quiral), es decir, un átomo de carbono unido a cuatro grupos diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos o enantiómeros. Aunque todos los átomos están en la misma posición y enlazados de igual manera, la molécula completa no se puede superponer con su imagen en un espejo, como ocurre con tus manos derecha e izquierda.
Los isómeros ópticos tienen las mismas propiedades físicas y químicas, pero se diferencian en cómo desvían la luz polarizada:
- Un isómero desvía la luz hacia la derecha (como las manecillas del reloj) y se llama dextrógiro (se representa con el signo +).
- El otro isómero la desvía hacia la izquierda (en sentido contrario a las manecillas del reloj) y se llama levógiro (se representa con el signo -).
Si una molécula tiene n átomos de carbono asimétricos, tendrá un total de 2n isómeros ópticos.
Diasteroisómeros: No son imágenes especulares
Cuando un compuesto tiene más de un carbono asimétrico, puede tener formas que no son exactamente copias especulares. A estas formas se les llama diasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol tiene dos carbonos asimétricos, lo que le da 4 formas posibles. Algunas son enantiómeros (imágenes especulares), pero otras son diastereoisómeros (no son imágenes especulares).
Mezcla racémica y formas meso: Sin efecto en la luz
Una mezcla racémica es una mezcla que tiene la misma cantidad de un isómero dextrógiro y de un isómero levógiro. Esta mezcla no desvía la luz polarizada, es decir, es ópticamente inactiva.
Si un compuesto tiene dos carbonos asimétricos, uno dextrógiro y otro levógiro, pero la molécula tiene un plano de simetría, en conjunto se comporta como ópticamente inactiva y se llama forma meso. Un ejemplo es el ácido tartárico.
Poder rotatorio específico: Midiendo la desviación de la luz
Es la cantidad de desviación que sufre la luz polarizada cuando atraviesa una solución de una sustancia. Es el mismo para ambos enantiómeros, pero con signo contrario. Se mide con un instrumento llamado polarímetro.
Isomería en química inorgánica
Aunque es menos común que en la química orgánica, la isomería también existe en compuestos inorgánicos, especialmente en los complejos de coordinación. Algunos tipos son:
- Isomería estructural: Los átomos se unen de forma diferente.
- Isomería conformacional: Similar a la de los compuestos orgánicos, por rotación de enlaces simples.
- Isomería cis-trans (geométrica): Los átomos o grupos se encuentran en diferentes posiciones alrededor de un átomo central.
- Isomería de posición: Un grupo se encuentra en diferentes lugares.
- Isomería óptica: También aparece en algunos compuestos inorgánicos con una estructura especial.
- Isomería de ionización: Se intercambian partes de la molécula entre el catión y el anión.
- Isomería de coordinación: Si ambos iones son complejos, se intercambian sus partes.
- Isomería de enlace: Algunos grupos pueden unirse de diferentes maneras al átomo central.
- Isomería de polimerización: Cuando dos moléculas tienen la misma fórmula empírica pero una es un múltiplo de la otra, como NO2 y N2O4.
Isomerización: El cambio de una molécula a otra
La isomerización es el proceso en el que una molécula se transforma en otra que tiene exactamente los mismos átomos, pero estos se reordenan. En algunas moléculas y bajo ciertas condiciones, la isomerización ocurre de forma espontánea. Muchos isómeros tienen energías similares, por lo que pueden convertirse entre sí si la energía necesaria para el cambio no es muy alta. Cuando la isomerización ocurre dentro de la misma molécula, se considera una reacción de transposición.
Véase también
 En inglés: Isomer Facts for Kids
En inglés: Isomer Facts for Kids