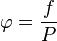Fugacidad para niños
La fugacidad es un concepto importante en la termodinámica química que nos ayuda a entender cómo se comportan los gases y otras sustancias en condiciones reales. Imagina que tienes un gas que no se comporta exactamente como un "gas ideal" (un modelo simple que usamos en ciencia). La fugacidad es como una "presión ajustada" que usamos para que las ecuaciones de los gases ideales funcionen también para los gases reales.
Piensa en ella como la "tendencia a escapar" de una sustancia. Si una sustancia tiene una alta fugacidad, significa que tiene una fuerte tendencia a expandirse o a pasar a otra fase (como de líquido a gas). Es como si las moléculas quisieran "huir" de donde están.
La fugacidad se mide en unidades de presión, como atmósferas o bares. Se usa para calcular con precisión el equilibrio químico, que es cuando las sustancias en una reacción dejan de cambiar y se mantienen estables.
Contenido
¿Qué es la fugacidad?
La fugacidad es una forma de medir la "presión efectiva" de un gas real. Un gas ideal es un modelo simple donde las partículas no interactúan entre sí. Pero en la realidad, los gases tienen partículas que sí interactúan. La fugacidad nos permite usar las fórmulas de los gases ideales para describir el comportamiento de los gases reales.
¿Cómo se relaciona con la presión?
La fugacidad (representada por la letra f) y la presión (P) de un gas real se conectan a través de algo llamado coeficiente de fugacidad (representado por la letra griega φ).
Para un gas ideal, la fugacidad y la presión son iguales, así que el coeficiente de fugacidad es 1 (φ = 1). Esto significa que los gases ideales no tienen esa "tendencia a escapar" extra que tienen los gases reales.
¿Por qué es importante la fugacidad?
Cuando los científicos quieren calcular con mucha precisión cómo se comportan los gases reales en una reacción química, usan la fugacidad en lugar de la presión. Esto es porque la fugacidad considera las interacciones entre las moléculas, lo que hace que los cálculos sean más exactos.
Por ejemplo, si tienes un líquido o un sólido en equilibrio con su vapor (como el agua hirviendo), la fugacidad del líquido o sólido es igual a la fugacidad del vapor. Esto nos ayuda a entender cómo las sustancias cambian de fase.
Historia de la fugacidad
La palabra fugacidad viene del latín fugere, que significa "huir". Este concepto fue introducido en la termodinámica en 1901 por un químico estadounidense llamado Gilbert N. Lewis. Él la popularizó en un libro importante que escribió con Merle Randall en 1923.
Lewis usó la idea de "tendencia a escapar" para describir cómo la materia se mueve entre diferentes fases (como de sólido a líquido o de líquido a gas). Era similar a cómo la temperatura describe el flujo de calor.
Fugacidad en sustancias puras
Para una sustancia pura (que no es una mezcla), la fugacidad está muy relacionada con su potencial químico. El potencial químico nos dice cuánta energía tiene una sustancia para reaccionar o cambiar.
Gases reales y gases ideales
Un gas ideal sigue una ecuación simple que relaciona su volumen, presión y temperatura. Sin embargo, los gases reales no siempre se comportan así. A presiones altas o temperaturas bajas, las moléculas de los gases reales interactúan entre sí, lo que cambia su comportamiento.
La fugacidad nos permite usar la misma ecuación que para los gases ideales, pero reemplazando la presión por la fugacidad. Esto hace que la ecuación sea precisa para los gases reales.
- A presiones muy bajas, la fugacidad de un gas real es casi igual a su presión.
- A medida que la presión aumenta, las interacciones entre las moléculas se vuelven más importantes, y la fugacidad puede ser diferente de la presión.
Ejemplo: Imagina nitrógeno (N2) a 0°C y una presión de 100 atmósferas. Su fugacidad es de 97.03 atm. Esto significa que el nitrógeno real a 100 atm se comporta, en términos de energía, como si fuera un gas ideal a 97.03 atm. El coeficiente de fugacidad sería 97.03 / 100 = 0.9703.
Fugacidad en líquidos y sólidos
La fugacidad también se puede definir para líquidos y sólidos. Aunque es difícil medirla directamente en estas fases, si un líquido o sólido está en equilibrio con su vapor, su fugacidad es igual a la fugacidad del vapor.
Cuando la presión de vapor no es muy alta, la fugacidad es aproximadamente igual a la presión de vapor de la sustancia.
Fugacidad en mezclas
La fugacidad es especialmente útil cuando trabajamos con mezclas de gases o líquidos. Nos ayuda a entender cómo se comporta cada componente dentro de la mezcla.
Mezclas de gases
En una mezcla de gases, cada gas tiene su propia fugacidad. La ley de Dalton dice que la presión total de una mezcla de gases es la suma de las presiones parciales de cada gas. De manera similar, las fugacidades en una mezcla de gases a menudo siguen una regla parecida, llamada regla de Lewis y Randall.
Mezclas de líquidos
En una mezcla líquida, la fugacidad de cada componente es igual a la de su vapor cuando están en equilibrio. En una solución ideal (donde las moléculas son muy parecidas), las fugacidades siguen la Ley de Raoult.
Si tienes una solución diluida (con un componente en mucha mayor cantidad que otro), el componente principal (el solvente) puede seguir la ley de Raoult, mientras que el componente en menor cantidad (el soluto) sigue otra ley llamada ley de Henry.
¿Cómo se calcula la fugacidad?
La fugacidad se puede calcular de varias maneras, a menudo usando mediciones de volumen y presión a una temperatura constante. También se pueden usar ecuaciones matemáticas complejas que describen el comportamiento de los gases y líquidos.
Una forma común de calcularla es a partir de la energía libre de Gibbs, que es una medida de la energía disponible para realizar trabajo en un sistema.
Cálculo para sustancias puras
Para sustancias puras, la fugacidad se puede calcular si se tienen datos de sus propiedades termodinámicas (como la entalpía y la entropía) a diferentes presiones y temperaturas.
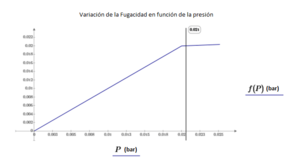
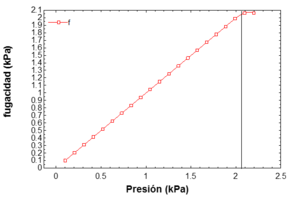
Ejemplo numérico: Para calcular la fugacidad del agua en Ayacucho a 18°C:
- La presión atmosférica en Ayacucho (a 2761 metros sobre el nivel del mar) es de aproximadamente 73.29 kPa.
- La presión de saturación del agua a 18°C es de 2.086 kPa.
- Usando fórmulas y datos de tablas termodinámicas, la fugacidad del agua a 73.29 kPa y 18°C se calcula en aproximadamente 2.061 kPa.
- Esto es muy similar a la fugacidad del agua en su estado de saturación (2.062 kPa), lo que muestra que para líquidos, la fugacidad no cambia mucho incluso a presiones más altas que la de saturación.
Para líquidos a presiones muy altas, se usa una corrección llamada factor de Poynting para calcular la fugacidad.
Fugacidad en sistemas con varias fases
En sistemas donde hay varias fases (como un líquido y un gas en equilibrio), la fugacidad es muy importante. Para que estas fases estén en equilibrio, la fugacidad de cada componente debe ser la misma en todas las fases.
Por ejemplo, en el equilibrio líquido-vapor de una sustancia pura, la presión, la temperatura y la fugacidad deben ser iguales en ambas fases.
Véase también
 En inglés: Fugacity Facts for Kids
En inglés: Fugacity Facts for Kids