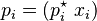Ley de Raoult para niños
La ley de Raoult es una regla importante en la química que nos ayuda a entender cómo se comportan las mezclas de líquidos. Imagina que tienes un líquido en un recipiente cerrado. Algunas de sus moléculas se escapan al aire de arriba, creando una presión que llamamos presión de vapor.
La ley de Raoult dice que, en una mezcla ideal de líquidos, la presión de vapor de cada líquido por separado es igual a la presión de vapor que tendría ese líquido si estuviera puro, multiplicada por la cantidad que hay de él en la mezcla. Esta cantidad se mide con algo llamado fracción molar.
En palabras más sencillas, si mezclas dos líquidos que se llevan muy bien (como si fueran "amigos" químicos), la presión que cada uno ejerce en el aire de arriba de la mezcla depende de cuánto de ese líquido hay y de lo fácil que se evapora por sí solo.
Contenido
Historia de la Ley de Raoult
La ley de Raoult fue descubierta por un químico francés llamado François-Marie Raoult en el año 1887. Él realizó muchos experimentos para entender cómo se evaporaban los líquidos cuando estaban mezclados.
¿Cómo funciona la Ley de Raoult?
Para entender la ley de Raoult, piensa en una mezcla de dos líquidos, A y B.
Presión de vapor de un componente
La presión de vapor de un líquido específico (llamémoslo "i") en una mezcla se calcula así:
Donde:
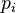 es la presión de vapor del líquido "i" en la mezcla.
es la presión de vapor del líquido "i" en la mezcla.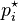 es la presión de vapor del líquido "i" cuando está puro (sin mezclar).
es la presión de vapor del líquido "i" cuando está puro (sin mezclar).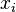 es la fracción molar del líquido "i" en la mezcla. La fracción molar es una forma de medir cuánto de un componente hay en una mezcla, como un porcentaje, pero en lugar de 100, el total es 1.
es la fracción molar del líquido "i" en la mezcla. La fracción molar es una forma de medir cuánto de un componente hay en una mezcla, como un porcentaje, pero en lugar de 100, el total es 1.
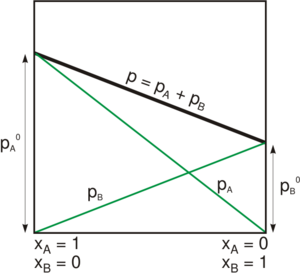
Presión de vapor total de una mezcla
Si tienes una mezcla de varios líquidos, la presión de vapor total de la mezcla es la suma de las presiones de vapor de cada uno de los líquidos por separado. Esto se combina con la ley de Dalton, que dice que la presión total de una mezcla de gases es la suma de las presiones de cada gas.
Donde:
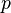 es la presión de vapor total de la mezcla.
es la presión de vapor total de la mezcla.- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): p^{\star}_{\rm A} y Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): p^{\star}_{\rm B} son las presiones de vapor de los líquidos A y B puros.
- Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): x_{\rm A} y Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): x_{\rm B} son las fracciones molares de los líquidos A y B en la mezcla.
¿Qué pasa si añades algo que no se evapora?
Si disuelves algo en un líquido que no se evapora (como la sal en el agua), la presión de vapor de la solución final será menor que la del líquido puro. Esto significa que el líquido se evapora menos fácilmente. La ley de Raoult nos dice que esta disminución de la presión de vapor es directamente proporcional a la cantidad de lo que añadiste.
¿Qué es una solución ideal?
La ley de Raoult funciona mejor para lo que llamamos "soluciones ideales". Una solución ideal es una mezcla donde las fuerzas de atracción entre las moléculas de los diferentes líquidos son muy parecidas a las fuerzas de atracción entre las moléculas del mismo líquido. Es como si las moléculas de los diferentes líquidos se llevaran tan bien como las moléculas de un mismo líquido.
Cuanto más parecidos son los líquidos que se mezclan, más se acercan a ser una solución ideal y mejor se cumple la ley de Raoult. Por ejemplo, si mezclas dos líquidos que solo se diferencian en sus isótopos (versiones ligeramente diferentes de los mismos átomos), la ley de Raoult será casi perfecta.
Si la presión de vapor que medimos es menor de lo que predice la ley de Raoult, significa que las fuerzas entre las moléculas diferentes son más fuertes. Si es mayor, significa que las fuerzas entre las moléculas diferentes son más débiles.
Soluciones reales: cuando las cosas no son ideales
En la vida real, muchas mezclas de líquidos no son "ideales". Esto significa que las fuerzas de atracción entre las moléculas de los diferentes líquidos no son iguales a las fuerzas entre las moléculas del mismo líquido. Cuando esto ocurre, la mezcla se desvía de lo que predice la ley de Raoult.
Desviación negativa
Si la presión de vapor de una mezcla es menor de lo que la ley de Raoult predice, decimos que hay una desviación negativa. Esto sucede cuando las moléculas de los diferentes líquidos se atraen más fuertemente entre sí que las moléculas del mismo líquido. Es como si se "agarraran" más fuerte, haciendo que sea más difícil para ellas escapar y convertirse en vapor.
Un ejemplo de esto es la mezcla de cloroformo y acetona. Estas dos sustancias forman un tipo de unión llamada puente de hidrógeno, que las mantiene más unidas.
Desviación positiva
Cuando las fuerzas de atracción entre las moléculas del mismo líquido son más fuertes que las fuerzas entre las moléculas diferentes, la presión de vapor es mayor de lo que la ley de Raoult predice. Esto se llama desviación positiva. En este caso, las moléculas de los diferentes líquidos no se atraen mucho entre sí, lo que les facilita escapar y convertirse en vapor.
Algunas mezclas que muestran una desviación positiva son:
Cuando estas mezclas se forman, a veces se siente un poco de frío, porque el proceso absorbe energía.
Soluciones de electrolitos
Para soluciones que contienen electrolitos (sustancias que se separan en iones cuando se disuelven, como la sal en agua), la ley de Raoult necesita un ajuste. Se usa un factor especial llamado factor de van 't Hoff para corregir la fórmula, ya que los iones se comportan de manera diferente a las moléculas normales.
Galería de imágenes
Véase también
 En inglés: Raoult's law Facts for Kids
En inglés: Raoult's law Facts for Kids