Óxido de mercurio(II) para niños
El óxido de mercurio(II), también conocido como óxido mercúrico, es un compuesto químico formado por mercurio y oxígeno. Su fórmula es HgO. Puede ser de color rojo o anaranjado y se encuentra en estado sólido a temperatura ambiente. Existe una forma natural muy poco común de este compuesto llamada montroidita.
Datos para niños
Óxido de mercurio(II) |
||
|---|---|---|
 |
||
 |
||
| Nombre IUPAC | ||
| Óxido de mercurio(II) | ||
| General | ||
| Otros nombres | Óxido mercúrico Montroidita |
|
| Fórmula molecular | HgO | |
| Identificadores | ||
| Número CAS | 21908-53-2 | |
| Número RTECS | OW8750000 | |
| ChEBI | 81882 | |
| UNII | IY191986AO | |
| KEGG | C18670 | |
|
InChI
InChI=InChI=1S/Hg.O
Key: QYZBCWXZSYTIOY-UHFFFAOYSA-N%22 UKWHYYKOEPRTIC-UHFFFAOYSA-N, QYZBCWXZSYTIOY-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Amarillo, naranja o rojo | |
| Densidad | 11 140 kg/m³; 1114 g/cm³ | |
| Punto de fusión | 773 K (500 °C) | |
| Índice de refracción (nD) | 2,5 (550 nm) | |
| Peligrosidad | ||
| NFPA 704 |
0
4
0
|
|
| Riesgos | ||
| Riesgos principales |   |
|
| Más información | ICSC 0981 | |
| Compuestos relacionados | ||
| Otros aniones | Sulfuro de mercurio(II) Seleniuro de mercurio(II) Telururo de mercurio(II) |
|
| Otros cationes | Óxido de zinc Óxido de cadmio |
|
| Otros comptos. de Hg y O | Óxido de mercurio(I) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
Contenido
Descubrimiento del oxígeno
En 1774, un científico llamado Joseph Priestley hizo un descubrimiento importante. Calentó óxido de mercurio y notó que se liberaba un gas. Aunque en ese momento no sabía que era oxígeno, este experimento fue clave para entender este elemento vital.
¿Cómo se obtiene el óxido de mercurio(II)?
El óxido de mercurio(II) se puede obtener de diferentes maneras, lo que resulta en dos formas principales: una roja y otra amarilla.
Formas y colores del óxido de mercurio
La forma roja del óxido de mercurio(II) se puede crear calentando mercurio en presencia de oxígeno a unos 350 grados Celsius. También se puede obtener calentando nitrato de mercurio(II).
La forma amarilla se consigue mezclando soluciones acuosas de mercurio con sustancias alcalinas, como el hidróxido de sodio. La diferencia de color entre la forma roja y la amarilla se debe al tamaño de las partículas, aunque ambas tienen una estructura similar.
Estructura del óxido de mercurio
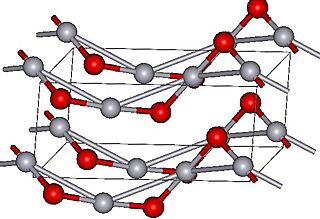
A presión normal, el óxido de mercurio(II) tiene dos estructuras cristalinas. Una se parece al mineral montroidita y la otra al cinabrio. Ambas estructuras están formadas por cadenas de átomos de mercurio y oxígeno. Si se aplica mucha presión, estas estructuras pueden cambiar a una forma diferente.
Usos del óxido de mercurio(II)
El óxido de mercurio(II) tiene varios usos importantes en la química y la tecnología.
- Se utiliza como un estándar para medir ciertos componentes en química.
- Es útil en la producción de mercurio, ya que se descompone fácilmente para liberar este elemento y oxígeno.
- También se usa como parte de las baterías de mercurio, específicamente en el cátodo (uno de los polos de la batería).
Precauciones con el óxido de mercurio(II)
Es muy importante saber que el óxido de mercurio(II) es una sustancia que debe manejarse con mucho cuidado.
Efectos en la salud
Esta sustancia puede ser absorbida por el cuerpo si se inhala en forma de partículas pequeñas, si entra en contacto con la piel o si se ingiere. Puede causar irritación en los ojos, la piel y las vías respiratorias. También puede afectar los riñones.
Riesgos ambientales
El óxido de mercurio(II) puede acumularse en los organismos acuáticos, lo que significa que se va juntando en sus cuerpos a lo largo del tiempo. Por esta razón, su uso como producto para controlar plagas está restringido en algunas regiones.
Reacciones y seguridad
A 20 grados Celsius, el óxido de mercurio(II) no se evapora mucho. Sin embargo, si se expone a la luz o se calienta por encima de 500 grados Celsius, se descompone. Al calentarse, puede liberar vapores de mercurio, que son muy dañinos, y oxígeno, lo que aumenta el riesgo de incendio. Reacciona fuertemente con ciertas sustancias, como el cloro o el magnesio caliente, y puede formar compuestos inestables si se mezcla con algunos metales o elementos como el azufre y el fósforo.
Véase también
 En inglés: Mercury(II) oxide Facts for Kids
En inglés: Mercury(II) oxide Facts for Kids



