Fotoquímica para niños
La fotoquímica es una parte de la química que estudia cómo la luz (o la radiación electromagnética) interactúa con los átomos y las moléculas pequeñas. Imagina que la luz es una llave que puede "encender" o iniciar reacciones químicas.
Para que una reacción fotoquímica ocurra, la luz debe ser absorbida por una sustancia. Esto se conoce como la primera ley de la fotoquímica o ley de Grotthus-Draper. Es como si la sustancia necesitara "sentir" la luz para poder cambiar.
La segunda ley de la fotoquímica, o ley de Stark-Einstein, dice que por cada pequeña partícula de luz (llamada fotón) que una sustancia absorbe, solo una molécula se activa para la reacción. Esto significa que la luz es muy eficiente en activar las moléculas una por una.
Normalmente, una reacción química necesita una "energía de activación" para empezar, como el calor o una chispa. En las reacciones fotoquímicas, ¡es la luz la que proporciona esa energía! La luz no solo da la energía necesaria, sino que también puede cambiar la forma en que los electrones de una molécula están organizados, abriendo caminos para reacciones que de otra manera no serían posibles.

Contenido
Conceptos clave de la fotoquímica
Los temas más importantes en fotoquímica incluyen el estudio de la luz ultravioleta (UV), las reacciones fotoquímicas en la química orgánica (que estudia los compuestos del carbono) y la fotosíntesis en la bioquímica (cómo las plantas usan la luz para crear su alimento).
Otros términos importantes son:
- Fotones: Las pequeñas partículas de luz.
- Absorción y emisión: Cómo las moléculas toman o liberan energía de la luz.
- Principio de Franck-Condon: Describe cómo los electrones y los núcleos de una molécula se mueven durante la absorción de luz.
- Niveles de energía: Los diferentes "escalones" de energía que pueden tener los electrones en una molécula.
- Espín: Una propiedad de los electrones.
- Efecto fotoeléctrico: Cuando la luz libera electrones de un material.
Leyes de Grotthuss-Draper y Stark-Einstein
El primer paso en un proceso fotoquímico es la fotoexcitación. Esto ocurre cuando una sustancia absorbe luz y sus electrones saltan a un nivel de energía más alto, creando un "estado excitado".
La Ley de Grotthuss-Draper nos dice que la luz debe ser absorbida por una sustancia para que ocurra una reacción fotoquímica. Si la luz no es absorbida, no hay reacción.
La Ley de Stark-Einstein explica que por cada fotón de luz que una sustancia absorbe, solo una molécula se activa para la reacción. Esto ayuda a entender la eficiencia de estas reacciones.
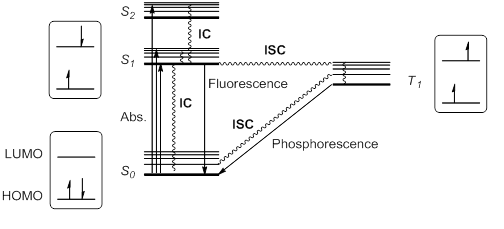
Fluorescencia y fosforescencia
Cuando una molécula absorbe luz, un electrón se "excita" y sube a un nivel de energía más alto. Este estado excitado puede volver a su estado original de varias maneras.
Una forma es la fluorescencia. En este proceso, la molécula excitada libera la energía extra en forma de luz casi de inmediato. Es lo que ves en los marcadores fluorescentes o en algunos juguetes que brillan.
Otra forma es la fosforescencia. Aquí, la molécula excitada también libera luz, pero lo hace de forma más lenta y durante más tiempo. Es por eso que algunos objetos brillan en la oscuridad después de haber estado expuestos a la luz.
Estas transiciones de energía se suelen mostrar en un diagrama de Jablonski, que es como un mapa de los niveles de energía de una molécula.
Las moléculas en estos estados excitados son muy reactivas. Pueden ganar o perder electrones fácilmente, lo que las hace participar en muchas reacciones químicas.
Cómo se hacen los experimentos fotoquímicos
Para hacer reacciones fotoquímicas en un laboratorio, se necesita una fuente de luz especial. Al principio, se usaba la luz del sol. Hoy en día, se usan lámparas de vapor de mercurio o LEDs, que emiten luz en longitudes de onda específicas. Los láseres también son muy útiles porque producen un solo tipo de luz.
Es importante que la luz llegue a la sustancia que queremos que reaccione. Por eso, los recipientes donde se hacen estas reacciones suelen ser de cuarzo, que deja pasar la luz ultravioleta. El Pyrex (un tipo de vidrio) absorbe la luz ultravioleta, así que no es adecuado para todas las reacciones.
El líquido donde se disuelve la sustancia (el disolvente) también es importante. Algunos disolventes pueden reaccionar con la luz o bloquearla, por lo que se eligen cuidadosamente. Por ejemplo, los disolventes que contienen hidrocarburos son buenos porque no absorben mucha luz.
Principios de las reacciones fotoquímicas
La luz es clave porque proporciona la energía de activación necesaria para que muchas reacciones ocurran. Si se usa luz láser, se puede activar una molécula de forma muy precisa.
Algunas reacciones fotoquímicas son muchísimo más rápidas que las reacciones que ocurren con calor. Pueden suceder en fracciones de segundo.
Un fotón puede ser absorbido directamente por la sustancia que reacciona, o por un "fotosensibilizador", que es una sustancia que absorbe la luz y luego transfiere esa energía a la sustancia que queremos que reaccione.
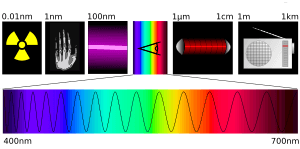
Regiones del espectro electromagnético
El espectro electromagnético es muy amplio, pero en fotoquímica se trabajan con algunas regiones principales:
- Luz visible: 400-700 nm (lo que nuestros ojos pueden ver).
- Ultravioleta: 100-400 nm (la luz que causa las quemaduras solares).
- Infrarrojo cercano: 700-1000 nm (se usa en controles remotos).
- Infrarrojo lejano: 15-1000 µm (se usa en cámaras térmicas).
Reacciones fotoquímicas en la vida diaria
Las reacciones fotoquímicas son muy importantes en la atmósfera. Por ejemplo, la luz del sol puede hacer que los gases de los coches y las fábricas (como los óxidos de nitrógeno y los hidrocarburos) reaccionen con el oxígeno. Esto forma nuevos contaminantes, como el smog fotoquímico.
El smog fotoquímico es una mezcla de contaminantes que se forma cuando la luz solar reacciona con los gases de la contaminación. A veces se le llama "una capa de ozono en un lugar equivocado", porque el ozono es bueno en la parte alta de la atmósfera (nos protege del sol), pero cerca del suelo es un contaminante que puede dañar nuestros pulmones. Ciudades como Los Ángeles suelen tener mucho smog debido al tráfico, el sol y las condiciones del clima.
Las reacciones fotoquímicas también se usan para limpiar aguas contaminadas. Se usa luz ultravioleta junto con sustancias como el agua oxigenada o el dióxido de titanio para descomponer la materia orgánica dañina.
Las fotorreacciones ocurren fácilmente porque la luz le da a la molécula más energía, haciéndola más reactiva. La ventaja de la fotoquímica es que es una forma directa y rápida de iniciar cambios químicos.
Leyes fundamentales de las fotorreacciones
Las reacciones fotoquímicas se rigen por leyes importantes:
- Ley de absorción de Grotthus-Draper: La luz solo puede causar un cambio químico si es absorbida por la sustancia. Si una sustancia no absorbe un tipo de luz, esa luz no la afectará. Por ejemplo, una sustancia verde absorbe la luz roja y azul, pero no la verde (la refleja, por eso la vemos verde). Solo la luz roja y azul podrán cambiarla.
- Ley energética: Para que la luz sea efectiva, debe tener suficiente energía para provocar la transformación química. La energía de la luz está relacionada con su longitud de onda: las ondas más cortas (como la luz ultravioleta) tienen más energía.
- Ley de la equivalencia fotoquímica (o ley de Einstein): En teoría, por cada fotón de luz absorbido, una molécula se descompone o se combina. Sin embargo, en la práctica, el número de moléculas que reaccionan a veces es diferente al número de fotones absorbidos. Esto se debe a que la reacción puede ser más compleja o reversible.
Tecnologías basadas en la fotoquímica
Una tecnología común que usa la fotoquímica es la fotografía tradicional. Las cámaras usan la luz que reflejan los objetos para impresionar una película. Esta película tiene una capa de sales de plata que son sensibles a la luz. Cuando la luz las golpea, las sales de plata cambian. Luego, en el proceso de revelado, ocurre una reacción química que hace que la imagen se vuelva visible.
Usos de los sistemas de reacción fotoquímica
Los reactores fotoquímicos se usan para transformar sustancias en otras que son más fáciles de detectar. Por ejemplo, pueden convertir un compuesto en uno que brille con fluorescencia o que sea más fácil de medir con otros métodos.
Las reacciones fotoquímicas pueden incluir:
- Fotólisis: Descomposición de una sustancia por la luz.
- Fotorreordenamientos: Cambios en la estructura de una molécula por la luz.
- Fotodimerización: Cuando dos moléculas se unen gracias a la luz.
- Fotoionización: Cuando la luz hace que una molécula pierda un electrón.
- Transferencia de electrones: Cuando la luz ayuda a que los electrones se muevan de una molécula a otra.
La cantidad de una sustancia que se convierte en una reacción fotoquímica depende de la cantidad, intensidad y longitud de onda de la luz que se usa. Cuanta más luz y más intensa sea, más reacción habrá. La energía de la luz en ciertas longitudes de onda es justo la necesaria para iniciar muchas reacciones químicas.
Galería de imágenes
Véase también
 En inglés: Photochemistry Facts for Kids
En inglés: Photochemistry Facts for Kids
- Célula fotoelectroquímica
- Efecto fotocromático
- Energía de ionización
- Fotólisis