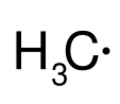Radical (química) para niños
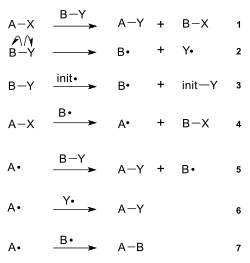
En química, un radical es un tipo especial de átomo o grupo de átomos. Lo que los hace únicos es que tienen uno o más electrones que no están emparejados. Imagina que los electrones son como calcetines: la mayoría de los átomos tienen sus electrones en pares, pero un radical tiene al menos un "calcetín" sin su pareja.
Debido a este electrón sin pareja, los radicales son muy reactivos. Esto significa que les encanta unirse rápidamente con otras moléculas para encontrar un compañero para su electrón. Por eso, suelen ser muy inestables y duran muy poco tiempo, a veces solo milisegundos. Se forman en medio de las reacciones químicas cuando una molécula se rompe de una manera especial.
Contenido
¿Cómo se nombran los radicales?
La Unión Internacional de Química Pura y Aplicada (IUPAC), que es como la autoridad mundial de la química, dice que ahora solo debemos usar el término radical. Antes se les llamaba "radicales libres", pero esa parte de "libre" ya no se usa, especialmente en la química que estudia los compuestos del carbono (química orgánica).
Antiguamente, la palabra "radical" se usaba para nombrar a un grupo de átomos que se unía a una molécula más grande. Cuando se descubrió que estos grupos podían existir por sí solos con un electrón sin pareja, se les añadió el "libre" para diferenciarlos. Hoy en día, esos grupos se nombran de otra forma, como "grupo metilo", y a los que tienen el electrón sin pareja se les llama simplemente radicales.
¿Cómo se descubrieron los radicales?
La idea de los radicales ha evolucionado con el tiempo gracias a muchos científicos.
Primeras observaciones de radicales
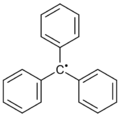
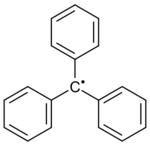
En 1900, un profesor de química llamado Moses Gomberg, de la Universidad de Míchigan, notó algo interesante. Al mezclar ciertas sustancias con plata y zinc, se formaba un producto de color amarillo muy reactivo. Él propuso que el responsable era un radical llamado radical trifenilmetilo.
Más tarde, en 1929, Friedrich Paneth y Wilhelm Hofeditz lograron producir el radical metilo (CH3). A diferencia del radical de Gomberg, el metilo era muy difícil de aislar. Esto demostró que los radicales pueden existir por un momento muy breve y que muchas reacciones químicas podrían involucrarlos.
El "efecto peróxido" y los radicales
En 1933, los científicos Kharasch y Mayo publicaron experimentos donde la presencia o ausencia de oxígeno cambiaba el resultado de una reacción. A esto lo llamaron el "efecto peróxido". En 1936, Kharasch explicó que esto ocurría por una reacción intermedia con el radical bromo (Br·).
Clasificación de las reacciones con radicales
En 1934, Rice y Herzfeld clasificaron las reacciones donde aparecen radicales. Las dividieron en:
- Iniciación: Cuando se forma un radical.
- Propagación: Cuando los radicales reaccionan, pero su número se mantiene.
- Inhibición: Cuando los radicales reaccionan y su número se mantiene, pero los productos desaparecen.
- Terminación: Cuando dos radicales se unen y desaparecen.
Radicales en los seres vivos
En 1939, Leonor Michaelis sugirió que cuando ciertas moléculas orgánicas se oxidan, se forma un radical como paso intermedio.
En 1946, Michaelis describió cómo el oxígeno se reduce en el cuerpo paso a paso, formando radicales como el superóxido (O2-) y el radical hidroxilo (HO·) antes de convertirse en agua.
En 1954, Rebeca Gerschman propuso que los radicales del oxígeno son la causa común de los efectos dañinos del oxígeno y la radiación en el cuerpo. Ella dijo que si hay mucho oxígeno o pocas defensas, las células y tejidos pueden dañarse.
Finalmente, en 1969, Joe M. McCord e Irwin Fridovich descubrieron una enzima llamada superóxido dismutasa. Esta enzima convierte el radical superóxido en peróxido de hidrógeno (agua oxigenada) y oxígeno. El descubrimiento de esta enzima confirmó que el radical superóxido existe de forma natural en nuestro cuerpo.
¿Qué características tienen los radicales?
Los radicales, aunque duren poco, existen por sí mismos. Se pueden crear en un laboratorio, se forman en la atmósfera por la radiación y también en los seres vivos, incluido el cuerpo humano.
En nuestro cuerpo, los radicales se forman por el contacto con el oxígeno. Pueden afectar las membranas de las células y dañar el material genético, como el ADN.
Los radicales tienen una configuración electrónica especial con al menos un electrón desapareado. Este electrón está muy dispuesto a formar un enlace químico con otro átomo o molécula. Son muy importantes en procesos como la combustión (cuando algo se quema), la polimerización (cuando se forman plásticos), en la química atmosférica y dentro de nuestras células.
Para representar un radical en una ecuación química, se suele poner un punto (·) justo a la derecha del símbolo del átomo o de la fórmula molecular. Por ejemplo:
- H2 + hν → 2 H· (reacción 1)
Este punto nos indica que hay un electrón sin pareja.
Tipos de radicales
Los radicales se pueden clasificar de varias maneras:
Según el número de átomos
- Monoatómicos: Son un solo átomo con un electrón sin pareja, como el radical cloro (Cl·) o el radical hidrógeno (H·).
- Poliatómicos: Están formados por más de un átomo, como el radical metilo (CH3·).
Según el átomo central con el electrón sin pareja
El átomo que tiene el electrón sin pareja es el "centro" del radical.
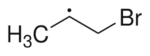
- Radicales centrados en el carbono: El electrón sin pareja está en un átomo de carbono. Por ejemplo, el radical metilo (.CH3). Dentro de estos, hay primarios, secundarios y terciarios, que tienen diferentes niveles de estabilidad.
| Radical primario | Radical secundario | Radical terciario |
|---|---|---|
 |
 |
|
| Radical etinilo | Radical 2.º derivado del 1-bromopropano |
Radical trifenilmetilo |
- Radicales centrados en el nitrógeno: Como el radical nitrato (·NO3).
- Radicales centrados en el oxígeno: Como el radical hidroxilo (·OH), que es muy reactivo.
- Radicales centrados en halógenos: Como el radical cloro (Cl·).
- Radicales centrados en metales: Como el radical (·SnH3).
Según la carga eléctrica
Los radicales pueden tener carga o no:
- Neutros: No tienen carga, como el Radical metilo.
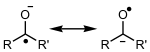
- Aniónicos: Tienen carga negativa, como el anión radical cetilo.
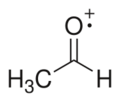
- Catiónicos: Tienen carga positiva, como el catión radical acetaldehído.
| Radical neutro | Anión radical | Catión radical |
|---|---|---|
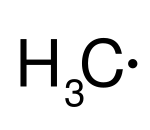 |
 |
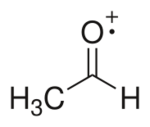 |
| Radical metilo (neutro) | Anión radical cetilo (efecto de resonancia) |
Catión radical acetaldehído |
Reacciones con radicales
Las reacciones en las que participan los radicales se llaman reacciones radicalarias. Generalmente, ocurren en tres etapas: iniciación, propagación y terminación.
- Reacciones de iniciación: Son las que crean nuevos radicales. Esto puede pasar por calor o luz, que rompen una molécula y forman radicales.
- Reacciones de propagación: Los radicales reaccionan con otras moléculas, formando nuevos radicales y productos. El número de radicales se mantiene.
- Reacciones de terminación: Los radicales se unen entre sí para formar moléculas más estables, y así desaparecen.
¿Cómo se producen radicales en los seres vivos?
Los radicales se producen en nuestro cuerpo durante la respiración, un proceso vital que usa oxígeno. Aunque el oxígeno es esencial, también puede generar estas moléculas reactivas. Con el tiempo, los radicales pueden causar efectos negativos en la salud porque pueden dañar el ADN (nuestros genes), las proteínas y las grasas de las células.
En nuestro cuerpo, algunas células se renuevan constantemente, como las de la piel, el intestino y el hígado. Con los años, los radicales pueden causar cambios en los genes de estas células, lo que podría aumentar el riesgo de cáncer. También pueden reducir la función de otras células, contribuyendo al envejecimiento.
Algunas situaciones que aumentan la producción de radicales en el cuerpo son:
- La contaminación del aire.
- Fumar.
- Comer muchas grasas.
- Exponerse demasiado a la luz solar.
- Consumir aceites vegetales que han sido muy procesados, ya que pueden contener radicales.
- El estrés.
Galería de imágenes
Véase también
 En inglés: Free radical Facts for Kids
En inglés: Free radical Facts for Kids