Enlace de hidrógeno para niños
El enlace de hidrógeno es una fuerza de atracción especial que ocurre entre átomos en las moléculas. Imagina que es como un imán débil que une partes de las moléculas o moléculas enteras entre sí. Esta fuerza se da cuando un átomo de hidrógeno, que está unido a un átomo muy "electronegativo" (como el flúor, el oxígeno o el nitrógeno), se siente atraído por otro átomo electronegativo cercano.
Esta atracción es mucho más débil que los enlaces químicos fuertes, como los enlaces covalentes o iónicos, pero es más fuerte que otras fuerzas de atracción débiles entre moléculas. Los enlaces de hidrógeno son muy importantes porque afectan muchas propiedades de las sustancias, como el punto en que hierven o se derriten. Por ejemplo, gracias a ellos, el agua hierve a 100 °C, lo cual es bastante alto para una molécula tan pequeña.
Los enlaces de hidrógeno pueden ocurrir de dos maneras:
- Entre moléculas diferentes (intermolecular): Por ejemplo, entre una molécula de agua y otra.
- Dentro de la misma molécula (intramolecular): Esto es clave para la forma de moléculas grandes y complejas, como las proteínas y el ADN, que son fundamentales para la vida.
Contenido
- ¿Qué es un Enlace de Hidrógeno?
- ¿Cómo se forma un Enlace de Hidrógeno?
- ¿Por qué son importantes los Enlaces de Hidrógeno?
- ¿Cuál es la diferencia entre "Enlace de Hidrógeno" y "Puente de Hidrógeno"?
- Historia de los Enlaces de Hidrógeno
- Fenómenos Curiosos Causados por los Enlaces de Hidrógeno
- Galería de imágenes
- Véase también
¿Qué es un Enlace de Hidrógeno?
Un enlace de hidrógeno es una fuerza de atracción electrostática. Esto significa que se basa en la atracción entre cargas eléctricas opuestas. Se forma cuando un átomo de hidrógeno, que tiene una pequeña carga positiva, es atraído por un átomo electronegativo (como el flúor, el oxígeno o el nitrógeno) de otra molécula o de la misma molécula, que tiene una pequeña carga negativa.
La energía de un enlace de hidrógeno es mucho menor que la de un enlace covalente, que es el tipo de unión que mantiene unidos a los átomos dentro de una molécula. Sin embargo, es lo suficientemente fuerte como para influir en las propiedades de muchas sustancias.
¿Cómo se forma un Enlace de Hidrógeno?
Para que se forme un enlace de hidrógeno, necesitamos dos partes:
- Un átomo donante: Es un átomo de hidrógeno que está unido a un átomo muy electronegativo (flúor, oxígeno o nitrógeno). Este átomo electronegativo "jala" los electrones del hidrógeno, dejando al hidrógeno con una pequeña carga positiva.
- Un átomo aceptor: Es un átomo electronegativo (flúor, oxígeno o nitrógeno) que tiene electrones "libres" (pares de electrones no compartidos). Estos electrones libres son atraídos por la carga positiva del hidrógeno donante.
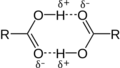
Un ejemplo de donante es el etanol, donde un hidrógeno está unido a un oxígeno. Un ejemplo de aceptor es el oxígeno en el éter dietílico, que tiene pares de electrones libres. Incluso el carbono puede participar en enlaces de hidrógeno si está unido a átomos muy electronegativos, como en el cloroformo.
Los enlaces de hidrógeno tienen algunas características que los hacen parecerse un poco a los enlaces covalentes, como que son direccionales y pueden hacer que los átomos estén más cerca de lo esperado.
¿Por qué son importantes los Enlaces de Hidrógeno?
Los enlaces de hidrógeno son vitales para muchas cosas en la naturaleza y en la química:
El Agua y los Enlaces de Hidrógeno
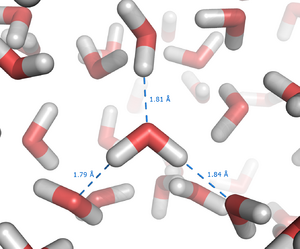
El ejemplo más conocido de enlaces de hidrógeno es el agua (H2O). Cada molécula de agua tiene un átomo de oxígeno y dos átomos de hidrógeno. El oxígeno tiene dos pares de electrones libres, y los hidrógenos pueden formar enlaces con otros oxígenos. Esto permite que cada molécula de agua se una a otras cuatro moléculas de agua.
Esta red de enlaces de hidrógeno es la razón por la que el agua tiene un punto de ebullición tan alto (100 °C) y por qué el hielo flota. En el hielo, los enlaces de hidrógeno forman una estructura más abierta, lo que hace que sea menos denso que el agua líquida.
Enlaces de Hidrógeno en Moléculas Grandes
En las moléculas muy grandes, como las proteínas y los ácidos nucleicos (ADN y ARN), los enlaces de hidrógeno son fundamentales para su forma y función. Por ejemplo, en el ADN, los enlaces de hidrógeno mantienen unidas las dos cadenas que forman su famosa doble hélice. En las proteínas, ayudan a que la cadena de aminoácidos se pliegue en formas específicas, lo cual es esencial para que funcionen correctamente.
También son importantes en materiales como la seda, la celulosa (en las plantas) y algunos plásticos sintéticos, dándoles sus propiedades únicas.
¿Cuál es la diferencia entre "Enlace de Hidrógeno" y "Puente de Hidrógeno"?
Es muy importante saber que "enlace de hidrógeno" y "puente de hidrógeno" son dos cosas diferentes en química, aunque a veces se confunden.
El enlace de hidrógeno es la fuerza de atracción débil que hemos estado describiendo, que une un hidrógeno con un átomo electronegativo. Es una fuerza entre moléculas o dentro de una molécula, pero no es un enlace químico fuerte como los covalentes.
El puente de hidrógeno es un tipo de enlace covalente no convencional. Se forma cuando un átomo de hidrógeno se comparte entre dos átomos, pero de una manera especial, usando solo dos electrones para unir tres átomos (un enlace de tres centros y dos electrones). Esto es mucho más fuerte que un enlace de hidrógeno y se usa para estabilizar ciertas moléculas.
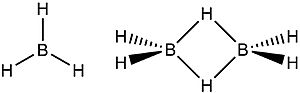
Ejemplos de Puentes de Hidrógeno: Los Boranos
Un buen ejemplo de puentes de hidrógeno se encuentra en los compuestos llamados boranos. El borano más simple (BH3) es inestable. Para volverse estable, dos moléculas de BH3 se unen para formar el diborano (B2H6). En el diborano, se forman dos puentes de hidrógeno donde un átomo de hidrógeno se comparte entre dos átomos de boro. Esto permite que cada átomo de boro tenga ocho electrones a su alrededor, lo que los hace estables, como los gases nobles.
Este tipo de enlace (B-H-B) es un verdadero enlace químico, aunque sea especial, y es muy diferente de la atracción débil de un enlace de hidrógeno.
Historia de los Enlaces de Hidrógeno
La idea de los enlaces de hidrógeno fue mencionada por primera vez en 1912 por T.S. Moore y T.F. Winmill. Ellos usaron esta idea para explicar por qué algunas sustancias eran menos básicas de lo esperado. La descripción más conocida del enlace de hidrógeno en el agua fue propuesta unos años después, en 1920, por Latimer y Rodebush.
Fenómenos Curiosos Causados por los Enlaces de Hidrógeno
Los enlaces de hidrógeno son responsables de muchas propiedades interesantes y útiles:
- Puntos de ebullición altos: El amoníaco (NH3), el agua (H2O) y el fluoruro de hidrógeno (HF) tienen puntos de ebullición mucho más altos que compuestos similares, gracias a los enlaces de hidrógeno.
- Viscosidad: Sustancias como el ácido fosfórico y el glicerol son muy viscosas (espesas) debido a la gran cantidad de enlaces de hidrógeno que forman.
- Solubilidad: Muchos compuestos se disuelven bien en agua porque pueden formar enlaces de hidrógeno con las moléculas de agua.
- Hielo flotante: Como mencionamos, el hielo es menos denso que el agua líquida debido a la estructura abierta que forman los enlaces de hidrógeno al congelarse.
- Goma inteligente: Algunas gomas especiales pueden "curarse" si se rompen, porque sus enlaces de hidrógeno pueden reformarse entre las superficies rotas.
Galería de imágenes
Véase también
 En inglés: Hydrogen bond Facts for Kids
En inglés: Hydrogen bond Facts for Kids