Fluoración del agua potable para niños
La fluoración del agua potable es un proceso controlado donde se añade una pequeña cantidad de un compuesto de flúor al agua que bebemos en nuestras casas. El objetivo principal es aumentar los niveles de flúor en el agua hasta una cantidad ideal que ayude a prevenir las caries dentales. Se busca una concentración que sea suficiente para proteger los dientes, pero no tan alta que cause un problema llamado fluorosis dental, que es cuando aparecen manchas en el esmalte de los dientes.
Sin embargo, la fluoración del agua ha generado debates debido a posibles efectos no deseados en la salud. Por esta razón, algunos países han decidido no practicarla o la han prohibido.
En lugares donde el agua no está fluorada, a veces se promueve el consumo de sal o leche que sí contienen flúor. De esta manera, las personas pueden elegir si quieren consumir estos productos con flúor o no. En cambio, cuando el agua de la red pública está fluorada, todos los consumidores la reciben, lo que significa que no tienen esa opción de elegir.
La OMS sugiere que cada comunidad use solo un método de fluoración (ya sea en el agua, la sal o la leche). También recomienda combinar esto con el uso de pastas de dientes con flúor y vigilar de cerca la aparición de fluorosis dental para asegurarse de que no haya un aumento excesivo.
Contenido
Historia de la fluoración del agua
Descubrimiento y primeros estudios
En 1901, un dentista llamado Frederick McKay, que trabajaba en Colorado Springs, Estados Unidos, notó algo curioso en los dientes de muchos de sus pacientes. Observó que tenían manchas permanentes, especialmente aquellos que habían vivido allí toda su vida. A esta coloración se le conocía como "tinción del Colorado", y McKay la llamó "esmalte moteado".
McKay sospechó que el problema estaba relacionado con el agua que bebían. Un químico llamado H.V. Churchill, que trabajaba para una empresa en la zona, se ofreció a analizar muestras de agua. Él quería asegurarse de que su empresa no fuera la culpable de algún vertido que causara el esmalte moteado.
Al analizar las muestras, Churchill encontró un elemento que llamó su atención por su alta concentración en el agua: el flúor.
La investigación de las "21 ciudades"
A raíz de este descubrimiento, el Servicio Nacional de Salud Pública de Estados Unidos inició una investigación importante, conocida como el estudio de las "21 ciudades". El objetivo era entender la relación entre el flúor, el esmalte moteado y las caries dentales. Los resultados de este estudio, publicados en 1942, llevaron a la recomendación de añadir flúor al agua potable para combatir las caries. Se sugirió una concentración de entre 0,7 y 1,2 ppm (partes por millón), un rango que se ha mantenido casi igual hasta hoy en los lugares donde se fluoriza el agua.
Mitos y estudios sobre el flúor
En los años 70, surgió la idea de que la fluoración podría causar cáncer. Se realizaron estudios en animales que mostraron una posible relación entre el cáncer de huesos y el consumo de grandes cantidades de flúor. Sin embargo, en los años 80 y 90, se llevaron a cabo estudios a gran escala en todo Estados Unidos. Estos estudios concluyeron que no había una forma de relacionar el consumo de flúor con ningún tipo de cáncer, y tampoco se encontró una concentración más alta de flúor en los huesos de las personas estudiadas.
Usos del flúor en el mundo
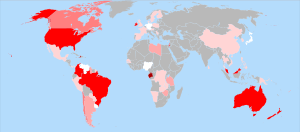
La fluoración del agua es muy común en los Estados Unidos. También se ha implementado en muchas otras partes del mundo, como Argentina, Australia, Brasil, Canadá, Chile, Colombia, Corea del Sur, España (especialmente en el País Vasco), Filipinas, Hong Kong, Irlanda, Israel, Malasia, Nueva Zelanda, Singapur, Reino Unido y Vietnam. Se calcula que alrededor de 355 millones de personas en todo el mundo (aproximadamente el 5.7% de la población mundial) beben agua fluorada artificialmente.
Además, se estima que al menos 50 millones de personas en el mundo beben agua con niveles naturalmente altos de flúor. Esto ocurre en países como Argentina, Francia, Gabón, Libia, México, Sri Lanka, Tanzania, Estados Unidos y Zimbabue. En algunos lugares, como partes de Senegal, Sri Lanka, China e India, la concentración de flúor en el agua supera los niveles recomendados. Se calcula que en China, unos 200 millones de habitantes consumen agua con niveles de flúor iguales o superiores a los aconsejados. Un consumo excesivo de flúor puede causar fluorosis dental y otros efectos en los huesos.
El flúor y sus compuestos
¿Qué es el flúor?
El flúor es un elemento químico que se encuentra de forma natural en la Tierra. Forma compuestos con la mayoría de los demás elementos, excepto con los gases nobles como el helio, el argón y el neón, que no se combinan con ningún otro elemento. El nombre "flúor" fue sugerido por A. Ampere a Humphry Davy en 1812. Sin embargo, fue Ferdinand Fréderic Henri Moissan quien logró aislarlo a principios del siglo XX. Moissan ganó el Premio Nobel en 1906 por este trabajo. Aislar el flúor fue difícil porque es el elemento más "electronegativo", lo que significa que su ion es muy difícil de "oxidar" (perder electrones).
Una vez aislado, el flúor es un gas de color amarillo pálido. Es el miembro más ligero de un grupo de elementos llamados halógenos. Su masa atómica es de aproximadamente 18.998. Se congela a -219.62 grados Celsius (53.54 K) y hierve a -188.12 grados Celsius (85.02 K). Es tan reactivo que no existe en su estado puro en la naturaleza. Sin embargo, los enlaces que forma con otros elementos son muy fuertes.
¿Dónde encontramos el flúor?
Se conocen alrededor de 170 minerales que contienen flúor. Los más comunes son la fluorita (CaF2) y la apatita (Ca5(PO4)3 (F,OH,CI,1/2CO3)). La apatita es una fuente importante de fosfatos que se usan como fertilizantes.
Aunque la mayoría de las personas no se dan cuenta de cómo se usa el flúor en la industria, algunos de sus compuestos son muy conocidos en productos cotidianos. Por ejemplo, se añaden a las pastas de dientes para proteger los dientes y se usan en recubrimientos antiadherentes para sartenes y hojas de afeitar, como el teflón.
La hidroxiapatita y los dientes
¿Qué es la hidroxiapatita?
La hidroxiapatita es un mineral que forma parte de nuestros dientes. Su fórmula es Ca5(PO4)3 OH. Los cristales de hidroxiapatita en el esmalte dental tienen forma de prismas hexagonales. Estos cristales pueden cambiar su composición. Por ejemplo, los iones hidroxilo (OH) pueden ser reemplazados por iones fluoruro (F), lo que puede modificar una parte de los iones originales.
¿Cómo protege el flúor los dientes?
Una bacteria llamada Streptococcus mutans es la principal responsable de las caries. Esta bacteria consume rápidamente los azúcares, especialmente la sacarosa, y produce ácidos. Estos ácidos disuelven los cristales de hidroxiapatita del esmalte, causando la ruptura del diente.
Cuando se consume flúor en bajas concentraciones (como 1 ppm), la hidroxiapatita de los dientes se transforma en fluorapatita. La fluorapatita es más resistente a los ácidos producidos por las bacterias, lo que ayuda a proteger el esmalte y a prevenir las caries.
Véase también
 En inglés: Water fluoridation Facts for Kids
En inglés: Water fluoridation Facts for Kids