Transición de fase para niños
En química, termodinámica y otras áreas de la ciencia, las transiciones de fase (o cambios de fase) son procesos físicos donde una sustancia cambia de un estado a otro. Imagina el agua: puede ser hielo (sólido), agua líquida o vapor (gas). Estos son diferentes estados de la materia, y cuando el agua pasa de uno a otro, decimos que hay una transición de fase.
Cada estado de una sustancia tiene propiedades físicas uniformes. Durante una transición de fase, algunas propiedades de la sustancia cambian, a veces de forma repentina. Esto ocurre por cambios en condiciones externas como la temperatura o la presión. Por ejemplo, cuando calientas agua hasta su punto de ebullición, se convierte en gas, y su volumen cambia mucho de repente. Medir las condiciones en las que ocurren estos cambios nos ayuda a entender las transiciones de fase. Son muy comunes en la naturaleza y se usan en muchas tecnologías.
Contenido
¿Qué tipos de transiciones de fase existen?
Hay muchos ejemplos de transiciones de fase. Los más conocidos son los cambios entre los estados sólido, líquido y gaseoso de una sustancia, que ocurren por cambios de temperatura o presión.
 |
A | ||||
|---|---|---|---|---|---|
| Sólido | Líquido | Gas | Plasma | ||
| De | Sólido | Fusión (derretir) | Sublimación (pasar a gas sin ser líquido) | ||
| Líquido | Solidificación (congelar) | Vaporización (evaporar o hervir) | |||
| Gas | Deposición (pasar a sólido sin ser líquido) | Condensación (pasar a líquido) | Ionización (pasar a plasma) | ||
| Plasma | Recombinación (pasar a gas) | ||||
Otros tipos de transiciones de fase incluyen:
- Cuando un líquido con dos componentes se enfría y se convierte en dos sólidos diferentes (transformación eutéctica).
- Cuando un material magnético cambia de ser ferromagnético (como un imán) a paramagnético (no magnético) al calentarse hasta el punto de Curie.
- Cuando algunos metales se enfrían mucho y se vuelven superconductores, lo que significa que conducen electricidad sin ninguna resistencia.
- Cambios en la forma en que los átomos se organizan en un material sólido, como el hierro que cambia entre ferrita y austenita.
- La condensación de Bose-Einstein, un estado especial de la materia que ocurre a temperaturas extremadamente bajas.
Las transiciones de fase ocurren porque la energía de un sistema cambia de una manera especial. Esto suele pasar en sistemas con muchas partículas.
En el punto donde ocurre una transición de fase (como el punto de ebullición), las dos fases de una sustancia (por ejemplo, líquido y vapor) tienen la misma energía. Esto significa que es igual de probable que existan. Por debajo del punto de ebullición, el líquido es más estable, y por encima, el gas es más estable.
A veces, es posible pasar de un estado a otro sin que ocurra la transición de fase de inmediato. El resultado es un estado "metaestable", que es menos estable de lo que debería ser, pero no inestable. Esto ocurre en fenómenos como el sobrecalentamiento o el sobreenfriamiento.
¿Cómo se clasifican las transiciones de fase?
Las transiciones de fase se pueden clasificar de diferentes maneras.
Clasificación de Ehrenfest
Un científico llamado Paul Ehrenfest clasificó las transiciones de fase según cómo cambia la energía de un sistema.
- Las transiciones de fase de primer orden son aquellas donde hay un cambio repentino en propiedades como la densidad. Por ejemplo, cuando el hielo se derrite o el agua hierve, la densidad cambia de golpe.
- Las transiciones de fase de segundo orden no tienen un cambio tan repentino en la primera propiedad, pero sí en una segunda propiedad. Un ejemplo es cuando un imán pierde su magnetismo al calentarse hasta el punto de Curie. La magnetización (la propiedad de ser magnético) cambia de forma continua, pero la susceptibilidad magnética (cómo responde a un campo magnético) cambia de forma repentina.
Aunque esta clasificación es útil, no es completa para todos los casos.
Clasificaciones modernas
Hoy en día, las transiciones de fase se dividen en dos categorías principales:
- Las transiciones de fase de primer orden son las que necesitan una cantidad de energía para ocurrir, llamada "calor latente". Durante este proceso, la temperatura del sistema se mantiene constante mientras se añade calor. Piensa en el hielo derritiéndose: el hielo y el agua coexisten a 0°C hasta que todo el hielo se derrite.
- Las transiciones de fase de segundo orden también se llaman transiciones de fase continuas. No necesitan calor latente. Ejemplos incluyen la transición de un material a superconductor o la transición de un imán a ferromagnético.
Además de estas, existen otras transiciones más complejas, como las transiciones de fase de orden infinito, que son continuas pero no rompen simetrías.
La transición vítrea es un caso especial. Ocurre en muchos líquidos que se enfrían muy rápido y se vuelven un "vidrio" en lugar de un cristal. El vidrio es un estado desordenado y sus propiedades dependen de cómo se enfrió.
Propiedades importantes de las transiciones de fase
Coexistencia de fases
A veces, durante una transición de fase, pueden coexistir dos fases diferentes de una sustancia. Por ejemplo, cuando el hielo se derrite, tienes hielo y agua líquida al mismo tiempo. En algunos materiales, esta coexistencia puede durar hasta temperaturas muy bajas. Esto es interesante para entender cómo se forman los vidrios.
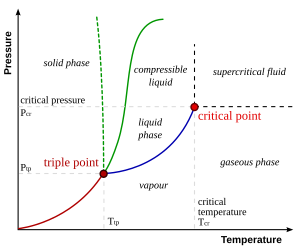
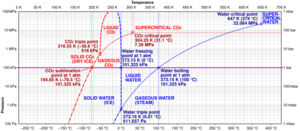
Puntos críticos
En sistemas que tienen fases líquida y gaseosa, hay un punto especial de presión y temperatura llamado el punto crítico. En este punto, la diferencia entre el líquido y el gas casi desaparece. Cerca de este punto, el fluido se ve lechoso, un fenómeno llamado opalescencia crítica.
Simetría
Las transiciones de fase a menudo implican una "ruptura de simetría". Imagina un líquido: es igual en todas partes. Pero cuando se congela y se convierte en un cristal, los átomos se organizan en un patrón repetitivo. Esto rompe la simetría, porque ahora no todos los puntos son iguales. Generalmente, la fase de alta temperatura tiene más simetrías que la fase de baja temperatura.
Parámetros de orden
Un parámetro de orden es una medida de cuán "ordenado" está un sistema durante una transición de fase. Generalmente, es cero en una fase (por ejemplo, por encima del punto crítico) y diferente de cero en la otra fase. Por ejemplo, en un imán, el parámetro de orden es la magnetización neta. Cuando el imán está caliente y no es magnético, la magnetización es cero. Cuando se enfría y se vuelve magnético, la magnetización es diferente de cero.
Estos parámetros de orden nos ayudan a describir el estado de un sistema cuando ocurre una transición de fase.
Importancia en la cosmología
Las transiciones de fase también son importantes para entender el universo primitivo. Se cree que, a medida que el universo se expandía y se enfriaba, el espacio vacío sufrió una serie de transiciones de fase. Estas transiciones ayudaron a formar las leyes de la física que conocemos hoy y a explicar por qué hay más materia que antimateria en el universo.
Exponentes críticos y clases de universalidad
Las transiciones de fase continuas tienen propiedades interesantes que se pueden describir con números llamados "exponentes críticos". Estos números nos dicen cómo cambian ciertas propiedades (como la capacidad de calor) cerca del punto de transición. Lo más sorprendente es que transiciones de fase en sistemas muy diferentes a menudo tienen los mismos exponentes críticos. Esto se llama universalidad. Por ejemplo, los exponentes críticos para el punto crítico líquido-gas son los mismos que para la transición de fase ferromagnética en ciertos imanes. Esto significa que, a pesar de sus diferencias, estos sistemas se comportan de manera similar cerca de sus puntos de transición.
Transiciones de fase en sistemas biológicos
Las transiciones de fase son muy importantes en los seres vivos. Por ejemplo:
- La formación de las membranas que rodean nuestras células.
- El proceso de plegamiento de las proteínas, que es crucial para que funcionen correctamente.
- La forma en que el ADN se compacta dentro de las células.
- En las membranas biológicas, el cambio de una fase "gel" a una fase "cristal líquido" es vital para su funcionamiento. Las plantas, por ejemplo, necesitan que las membranas de sus cloroplastos (donde hacen la fotosíntesis) se mantengan fluidas incluso a bajas temperaturas.
Se ha sugerido que algunos sistemas biológicos, como las redes neuronales o los grupos de animales, podrían estar cerca de puntos críticos. Esto significa que pequeños cambios pueden llevar a grandes transformaciones en su comportamiento.
Véase también
 En inglés: Phase change Facts for Kids
En inglés: Phase change Facts for Kids
- Alotropía
- Crecimiento de cristal
- Calorimetría diferencial de barrido
- Ecuaciones de Ehrenfest
- Teoría de Landau
- Lista de estados de la materia
- Teoría de la percolación