Tricloruro de nitrógeno para niños
Datos para niños
Tricloruro de nitrógeno |
||
|---|---|---|
 Estructura química.
|
||
 Estructura tridimensional.
|
||
| General | ||
| Otros nombres | Tricloroamina, Agene (denominación comercial antes de prohibirse en 1949) | |
| Fórmula estructural | 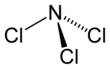 |
|
| Fórmula molecular | NCl3 | |
| Identificadores | ||
| Número CAS | 10025-85-1 | |
| Número RTECS | QW9740000 | |
| ChEBI | 37382 | |
| ChemSpider | 55361 | |
| PubChem | 61437 | |
|
InChI
InChI=InChI=1S/Cl3N/c1-4(2)3
Key: QEHKBHWEUPXBCW-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | Líquido Oleoso Amarillo Olor penetrante y desagradable |
|
| Densidad | 1653 kg/m³; 1,653 g/cm³ | |
| Riesgos | ||
| Ingestión | Peligroso. Desórdenes neurológicos intensos y generalizados. | |
| Inhalación | Los vapores irritantes y lacrimógenos. | |
| Más información | Hazardous Chemical Database | |
| Compuestos relacionados | ||
| Cloruros relacionados | Cloramina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El Tricloruro de nitrógeno, también conocido como tricloroamina, es un compuesto químico con la fórmula NCl3. Es un líquido amarillo y aceitoso con un olor muy fuerte y desagradable. Este compuesto se forma a menudo como un producto secundario de reacciones químicas entre el cloro y sustancias que contienen amoníaco, como ocurre en las piscinas.
Contenido
Tricloruro de nitrógeno: ¿Qué es y cómo se forma?
El tricloruro de nitrógeno es una sustancia química que se crea cuando el cloro se mezcla con compuestos de amoníaco. Su fórmula química, NCl3, nos dice que está hecho de un átomo de nitrógeno y tres átomos de cloro.
¿Cómo se prepara el tricloruro de nitrógeno?
Los científicos pueden preparar este compuesto tratando sales de amonio, como el nitrato de amonio, con cloro. Durante este proceso, se forman otras sustancias intermedias como la cloramina (NH2Cl) y la dicloramina (NHCl2).
La forma de la molécula
Al igual que el amoníaco, la molécula de NCl3 tiene una forma especial llamada piramidal. Imagina una pirámide con el átomo de nitrógeno en la punta y los tres átomos de cloro en la base. La distancia entre el nitrógeno y cada átomo de cloro es de 1.76 Å (un Ångström es una medida muy pequeña). Los ángulos entre los átomos de cloro y el nitrógeno son de 107 grados.
¿Dónde se encuentra el tricloruro de nitrógeno en la vida diaria?
Pequeñas cantidades de tricloruro de nitrógeno pueden aparecer cuando el agua potable se desinfecta con monocloramina. También se forma en las piscinas que usan cloro. Esto ocurre cuando el cloro reacciona con la urea, una sustancia que se encuentra en la orina de los bañistas.
Usos pasados y por qué se prohibió
Hace tiempo, el tricloruro de nitrógeno se vendía con el nombre de Agene. Se usaba para blanquear y conservar la harina de forma artificial. Sin embargo, en 1949, su uso fue prohibido. Esto sucedió después de que se descubriera en 1947 que causaba problemas de salud en las personas. Se observó que perros que comieron pan hecho con harina tratada con Agene sufrieron ataques. La sustancia que causaba estos problemas era la metionina sulfoximina.
¿Es peligroso el tricloruro de nitrógeno?
Sí, el tricloruro de nitrógeno es una sustancia peligrosa.
Efectos en la salud
Los vapores de tricloruro de nitrógeno pueden irritar las membranas mucosas, como las de la nariz y la garganta. También pueden causar lagrimeo en los ojos, actuando como un agente lacrimógeno.
Riesgos de explosión
La sustancia pura es muy explosiva. Es sensible a la luz, al calor y a golpes, incluso si son suaves. También puede reaccionar peligrosamente con compuestos orgánicos.
La historia de su descubrimiento muestra lo peligroso que es:
- Pierre Louis Dulong fue el primero en prepararlo en 1812. Lamentablemente, perdió dos dedos y un ojo debido a dos explosiones.
- En 1813, una explosión de NCl3 dejó temporalmente ciego a Humphry Davy. Esto lo llevó a contratar a Michael Faraday como su ayudante. Poco después, ambos resultaron heridos por otra explosión de NCl3.
Véase también
 En inglés: Nitrogen trichloride Facts for Kids
En inglés: Nitrogen trichloride Facts for Kids
- Cloramina
- Lista de incidentes de contaminación alimentaria


