Toxoplasma gondii para niños
Datos para niños Toxoplasma gondii |
||
|---|---|---|
 |
||
| Taxonomía | ||
| Dominio: | Eukaryota | |
| Reino: | Chromista | |
| Filo: | Miozoa | |
| Orden: | Eucoccidiida | |
| Familia: | Sarcocystidae | |
| Género: | Toxoplasma | |
El Toxoplasma gondii es un protozoo muy pequeño, un tipo de parásito que vive dentro de las células de otros seres vivos. Es el causante de una enfermedad llamada toxoplasmosis. Esta enfermedad suele ser leve, pero puede volverse grave, especialmente en gatos y en bebés antes de nacer.
Este parásito es muy común y puede infectar a cualquier animal de sangre caliente, incluyendo a los humanos. Se calcula que una gran parte de la población mundial ha estado infectada por T. gondii en algún momento.
Contenido
¿Cómo se ve el Toxoplasma gondii?
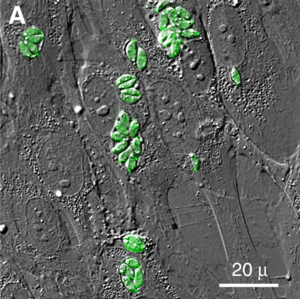
El Toxoplasma gondii cambia de forma a lo largo de su vida. Las formas principales son el taquizoíto, el bradizoíto y el ooquiste.
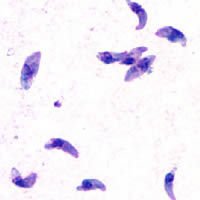
Taquizoíto: La forma activa
El taquizoíto es la forma que causa la infección aguda. Mide entre 4 y 8 micrómetros (μm) de largo y tiene forma de media luna. Un micrómetro es una millonésima parte de un metro, ¡así que es muy, muy pequeño!
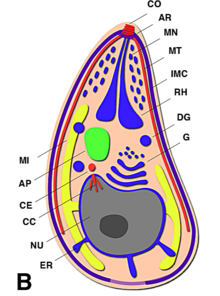
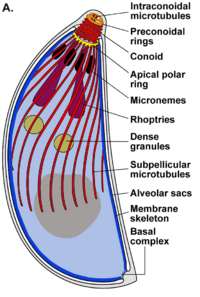
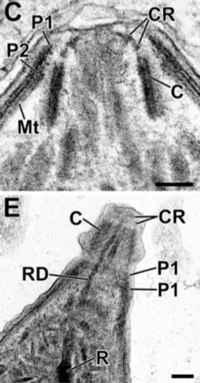
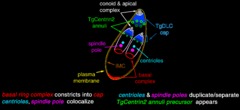
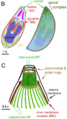
En un extremo del taquizoíto, hay un grupo de estructuras llamado "complejo apical". Este complejo es muy importante para que el parásito pueda entrar en las células y multiplicarse.
El complejo apical: Una herramienta de invasión
El complejo apical es como un conjunto de herramientas que el parásito usa para invadir las células. Está formado por fibras que se enrollan y le dan una forma puntiaguda. También tiene varias membranas que lo ayudan a liberar sustancias para entrar en las células.
Este complejo no solo es una estructura, sino que también ayuda a organizar el parásito y a liberar sustancias que le permiten invadir.
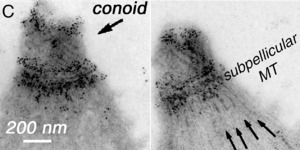
El conoide: Un motor para el movimiento
El conoide es una parte del complejo apical hecha de fibras que se mueven. Esto le permite al T. gondii moverse activamente cuando está invadiendo las células de un animal.
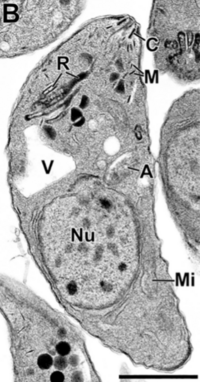
Cuando el T. gondii invade una célula, crea una especie de burbuja protectora llamada vacuola parasitófora. Esta burbuja lo aísla y lo protege dentro de la célula.
El parásito también tiene unas estructuras especiales que liberan sustancias para ayudarlo a entrar en la célula y formar esta burbuja.
Ooquiste: La forma resistente
Un ooquiste es una forma del Toxoplasma que puede sobrevivir mucho tiempo fuera de un animal. Es como una "semilla" resistente del parásito, que se forma después de su reproducción en el intestino de los gatos.
Los gatos infectados pueden liberar ooquistes en sus heces. Estos ooquistes necesitan unos días para madurar y volverse infecciosos. Gracias a su pared gruesa, pueden sobrevivir bien en el ambiente.
Bradizoíto: La forma durmiente
El bradizoíto es una forma del parásito que se reproduce lentamente. En las infecciones de toxoplasmosis que duran mucho tiempo (crónicas), los bradizoítos se agrupan en pequeñas "bolsas" llamadas quistes. Estos quistes se encuentran en los músculos y el cerebro de los animales infectados.
Taquizoíto: La forma de replicación rápida
Los taquizoítos son las formas que se mueven y se multiplican rápidamente. Se encuentran dentro de las células infectadas. Invaden y se reproducen hasta que la célula se rompe, liberando más taquizoítos. Estos activan el sistema de defensa del cuerpo y pueden convertirse en bradizoítos, que se dividen más lentamente.
Algunas partes que se pueden ver en una imagen de microscopio de un taquizoíto son: apicoplasto (A), anillo polar apical (APR), conoide (C), anillo conoidal (CR), aparato de Golgi (G), complejo de membrana interna (IMC), micronemas (M), mitocondria (Mi), microtúbulos (Mt), núcleo (Nu), roptrías (R), conducto de roptría (RD), vacuola (V).
Genoma y tipos de T. gondii
La mayoría de los tipos de T. gondii en el mundo pertenecen a tres grupos principales (tipo I, tipo II y tipo III). Aunque son muy parecidos genéticamente, pueden causar enfermedades de diferente gravedad.
Por ejemplo, el tipo I se asocia con problemas graves en bebés antes de nacer en algunos países. El tipo II es el más común en humanos en Estados Unidos, y el tipo III se encuentra más en animales.
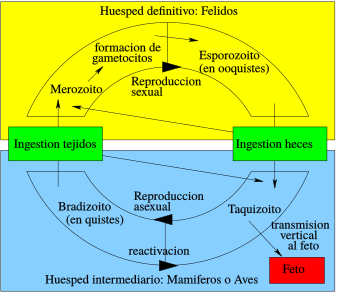
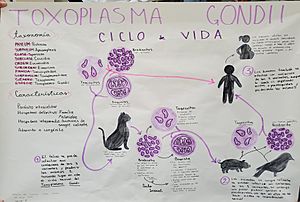
El ciclo de vida del Toxoplasma
El ciclo de vida del T. gondii tiene dos partes. La parte sexual solo ocurre en los Felidae (gatos domésticos y salvajes), por eso se les llama los "huéspedes definitivos". La parte asexual puede ocurrir en cualquier animal de sangre caliente, como otros mamíferos y aves. Por esta razón, la toxoplasmosis es una enfermedad que puede pasar de animales a humanos (una zoonosis).
Este parásito puede infectar de tres maneras:
- Taquizoítos: Se liberan de los bradizoítos y pueden entrar en cualquier célula, infectándola.
- Bradizoítos: Entran en el cuerpo en forma de quistes. Una vez dentro, pueden liberar taquizoítos o, en el caso de los felinos, pueden formar células sexuales para crear un ooquiste.
- Ooquistes: Esta forma de infección solo se produce en los felinos, ya que solo en ellos el parásito puede reproducirse sexualmente. Los ooquistes se forman a partir de las células sexuales y se liberan en las heces de los gatos. Cada ooquiste contiene pequeñas formas infecciosas.
Las personas pueden infectarse al consumir agua o alimentos contaminados con ooquistes, o al comer carne cruda o mal cocida que contenga quistes.
Dentro de un animal infectado, los parásitos invaden las células y forman quistes, especialmente en los músculos y el cerebro. Como el parásito está dentro de las células, el sistema inmunitario del animal no siempre los detecta fácilmente.
El T. gondii se multiplica dentro de estas burbujas protectoras hasta que la célula infectada se rompe, liberando más taquizoítos. Estos taquizoítos son muy activos, pero el sistema inmunitario del animal puede eliminarlos. Sin embargo, algunos logran infectar otras células, manteniendo así el ciclo del parásito.
Cuando un gato come un ratón infectado, los quistes del ratón sobreviven en el estómago del gato. Los parásitos infectan las células del intestino delgado del gato, donde se reproducen sexualmente y forman ooquistes, que son liberados con las heces del gato. Otros animales, incluyendo los humanos, pueden ingerir estos ooquistes (por ejemplo, al comer vegetales que no se lavaron bien) o los quistes de la carne (al comer carne cruda o mal cocida). El T. gondii puede infectar casi cualquier tipo de célula en el cuerpo, excepto los glóbulos rojos.
¿Cómo se transmite el Toxoplasma gondii?
Los humanos pueden infectarse con Toxoplasma gondii de varias maneras:
- Por la boca: Al ingerir ooquistes que están en el ambiente (por ejemplo, en tierra contaminada o alimentos sin lavar).
- Por la comida: Al comer carne cruda o poco cocida de animales que tienen los quistes (bradizoítos).
- De madre a bebé: Una madre infectada puede transmitir el parásito a su bebé durante el embarazo. Esto puede causar problemas en el desarrollo del bebé, como dificultades de aprendizaje, problemas de visión o audición, o incluso problemas más graves.
¿Qué es la toxoplasmosis?
La toxoplasmosis es la enfermedad causada por el T. gondii.
Síntomas y tratamiento
En la mayoría de las personas sanas, la infección por toxoplasmosis no causa síntomas o solo provoca síntomas leves, parecidos a los de un resfriado o gripe. A veces, puede haber inflamación de los ganglios linfáticos o problemas en los ojos.
En personas con un sistema inmunitario debilitado (por ejemplo, debido a ciertas enfermedades o tratamientos médicos), la toxoplasmosis puede ser más grave y causar problemas como inflamación del cerebro, que puede ser peligrosa.
Para tratar la toxoplasmosis, se usan medicamentos como la pirimetamina y las sulfonamidas. Estos medicamentos actúan sobre el parásito para detener su crecimiento.
En mujeres embarazadas, se puede usar un medicamento llamado espiramicina para intentar evitar que el parásito pase al bebé. Sin embargo, diagnosticar la infección en el embarazo puede ser complicado, y el tratamiento no siempre evita la transmisión si el parásito ya ha llegado al bebé.
Efectos en el cuerpo
La toxoplasmosis puede tener diferentes efectos dependiendo de cuándo se adquiere la infección.
- Si la infección ocurre al principio del embarazo, puede causar problemas muy serios para el bebé en desarrollo.
- Si ocurre más tarde, el bebé puede nacer con problemas de salud que afectan el cerebro, el hígado, los ojos u otros órganos.
En general, la toxoplasmosis en mujeres embarazadas rara vez causa síntomas graves en la madre, pero puede provocar ganglios inflamados, fiebre o malestar general.
Cambios en el comportamiento animal
Se ha observado que la infección por T. gondii puede cambiar el comportamiento de ratas y ratones. Por ejemplo, los ratones infectados pueden sentirse menos asustados por el olor de los gatos, e incluso acercarse a ellos, en lugar de huir. Esto beneficia al parásito, ya que si el ratón es comido por un gato, el parásito puede completar su ciclo de vida y reproducirse sexualmente dentro del gato.
Este cambio en el comportamiento es muy específico y no afecta otros miedos del ratón. Es un ejemplo de cómo un parásito puede manipular a su huésped para asegurar su propia supervivencia y reproducción.
Historia del descubrimiento
En 1908, dos científicos, Charles Nicolle y Louis Manceaux, descubrieron este parásito en un roedor llamado Ctenodactylus gundi en Túnez. Al mismo tiempo, en Brasil, Alfonso Splendore lo encontró en conejos. Le dieron el nombre de Toxoplasma gondii: "toxo" viene del griego "toxon" que significa "arco", por su forma arqueada, y "gondii" por el roedor donde fue descubierto.
Galería de imágenes
Véase también
 En inglés: Toxoplasma Facts for Kids
En inglés: Toxoplasma Facts for Kids