Tetróxido de dinitrógeno para niños
| Tetraóxido de dinitrógeno | |
|---|---|
 Tetraóxido de dinitrógeno |
|
 |
|
| General | |
| Nombre sistemático | Tetraóxido de dinitrógeno Óxido de nitrógeno(IV) |
| Fórmula química | N2O4 |
| Masa molecular | 92.011 u |
| Apariencia | Gas incoloro |
| Número CAS | 10544-72-6 |
| Enlace MSDS | Air Liquide MSDS (PDF) |
| Propiedades físicas | |
| Densidad | 1443 kg/m³ |
| Solubilidad | Reacciona en agua |
| Propiedades en estado sólido | |
| Entropía molecular (S0sólido) |
150.38 J/(mol•K) |
| Densidad | 1,44 g/cm³ |
| Seguridad | |
| Ingestión | ? |
| Inhalación | Corrosivo y tóxico |
| Contacto con la piel | Corrosivo |
| Ojos | Corrosivo |
| OSHA Exposición permitida (PEL) |
5 ppm |
| NIOSH Peligroso para la vida y salud (IDLH) |
20 ppm |
| Precauciones | |
| Protección personal |
|
| Reacciona con |
|
| NFPA 704 |
0
3
0
OX
|
El tetraóxido de dinitrógeno (N2O4), también conocido como óxido de nitrógeno(IV), es un compuesto químico interesante. Es como una "pareja" de dos moléculas de dióxido de nitrógeno (NO2) que se unen. Por eso, a veces es difícil distinguirlos por su nombre, ya que ambos tienen nitrógeno y oxígeno. Además, estas dos sustancias están en un equilibrio químico constante, lo que significa que pueden transformarse una en la otra dependiendo de la temperatura y la presión.
Este compuesto es un oxidante muy potente, lo que significa que puede hacer que otras sustancias pierdan electrones. Es importante saber que es una sustancia peligrosa, ya que es muy corrosiva y puede ser dañina si se inhala o entra en contacto con la piel.
El tetraóxido de dinitrógeno es muy importante en el mundo de los cohetes. Se usa como un tipo de "comburente" (la sustancia que ayuda a quemar el combustible) porque reacciona muy bien con otros combustibles como la hidracina. Además, es fácil de almacenar. También es útil en la síntesis química, que es el proceso de crear nuevas sustancias.
Contenido
¿Cómo es su Estructura y Propiedades?
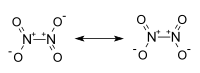
El tetraóxido de dinitrógeno tiene una forma plana, como una hoja. Sus átomos de nitrógeno están unidos entre sí y cada nitrógeno está unido a dos átomos de oxígeno. A diferencia del dióxido de nitrógeno, el N2O4 no tiene propiedades magnéticas.
Cuando está puro y a temperatura ambiente, es un gas que no tiene color. Es muy corrosivo y puede oxidar otras sustancias.
El Equilibrio entre N2O4 y NO2
Las moléculas de dióxido de nitrógeno (NO2) pueden unirse para formar tetraóxido de dinitrógeno (N2O4), y viceversa. Este proceso está en un equilibrio constante: <chem>N_2O_4 \rightleftharpoons 2NO_2\quad \Delta {\it H} =+57~{\rm kJ/mol}</chem>
Si la temperatura aumenta, el equilibrio se mueve hacia el lado del NO2. Esto significa que hay más dióxido de nitrógeno. Como el NO2 es de color marrón, la mezcla se vuelve más rojiza o parda a medida que la temperatura sube. Por encima de los 140 °C, casi todo el N2O4 se ha convertido en NO2. Si la temperatura baja, ocurre lo contrario.
Cuando el tetraóxido de dinitrógeno está en estado líquido, es principalmente N2O4. Es un líquido que se evapora fácilmente y tiene un olor fuerte. Su color es un poco marrón amarillento debido a la pequeña cantidad de dióxido de nitrógeno que siempre está presente. Se congela a -11 °C y hierve a 21.15 °C.
Si el tetraóxido de dinitrógeno reacciona con agua, forma una mezcla de ácido nítrico y ácido nitroso: 2NO2 + H2O = HNO3 + HNO2
Es muy importante saber que si se mezcla con sustancias orgánicas, puede causar explosiones.
¿Cómo se Produce este Compuesto?
Producción Industrial
Una forma de fabricar tetraóxido de dinitrógeno a gran escala es oxidando amoníaco. Primero, el amoníaco se quema con oxígeno para producir óxido nítrico y agua. Luego, el óxido nítrico se oxida a dióxido de nitrógeno, y finalmente, este se enfría para que se convierta en tetraóxido de dinitrógeno.
También se obtiene como un subproducto en las fábricas que producen ácido nítrico. El óxido nítrico que se genera se oxida con aire para formar dióxido de nitrógeno, y al enfriarse, se convierte en tetraóxido de dinitrógeno.
Producción en Laboratorio
En un laboratorio, se puede obtener de manera similar. Otra forma es reducir el ácido nítrico concentrado usando cobre, o calentando nitratos de metales pesados, como el nitrato de plomo, en presencia de oxígeno.
¿Para Qué se Utiliza el Tetraóxido de Dinitrógeno?
Como Combustible para Cohetes
El tetraóxido de dinitrógeno es muy usado en los cohetes como comburente. Se combina con combustibles hechos de hidracina (como la metilhidrazina o la dimetilhidrazina asimétrica). Cuando se mezclan, estas sustancias se encienden solas casi al instante, lo que es muy útil para los motores de cohetes.
Fue muy importante en los misiles balísticos intercontinentales de segunda generación, como el Titan II, a finales de los años 50. Esto permitía que los misiles estuvieran siempre listos para ser lanzados, a diferencia de los que usaban oxígeno líquido, que necesitaban refrigeración constante.
Después, se empezó a usar en los cohetes espaciales. Por ejemplo, se utilizó en el Programa Gemini de Estados Unidos, en las naves espaciales Apolo y en el transbordador espacial. Hoy en día, muchos satélites y sondas espaciales siguen usándolo. También es el comburente principal en cohetes rusos como el Protón, europeos como el Ariane y chinos como el Larga Marcha.
A veces, al tetraóxido de dinitrógeno que se usa en cohetes se le añade un poco de óxido nítrico. Esto ayuda a evitar la corrosión en las partes de titanio de las naves. A esta mezcla se le llama "MON".
En 1975, durante el proyecto Apollo-Soyuz, los astronautas de Estados Unidos tuvieron problemas de salud graves al inhalar accidentalmente este compuesto durante el descenso. Afortunadamente, se recuperaron después de recibir atención médica.
En la Generación de Energía
La capacidad del N2O4 de transformarse en NO2 y viceversa ha llevado a investigar su uso en sistemas avanzados para generar energía. El tetraóxido de dinitrógeno frío se comprime y se calienta, lo que hace que se separe en dióxido de nitrógeno. Este dióxido de nitrógeno caliente se expande a través de una turbina, se enfría y luego se recombina para volver a ser tetraóxido de dinitrógeno. Este ciclo puede hacer que los equipos de conversión de energía sean mucho más eficientes.
En la Síntesis Química
El tetraóxido de dinitrógeno también se usa para crear nuevos compuestos químicos, especialmente nitratos metálicos. Si se trabaja en un ambiente sin agua, se pueden formar nitratos metálicos covalentes con muchos metales de transición. Estos compuestos son interesantes porque muchos de ellos son volátiles a temperatura ambiente y tienen colores muy llamativos.
Galería de imágenes
Véase también
 En inglés: Dinitrogen tetroxide Facts for Kids
En inglés: Dinitrogen tetroxide Facts for Kids