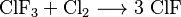Monofluoruro de cloro para niños
Datos para niños
Monofluoruro de cloro |
||
|---|---|---|
 |
||
 |
||
| General | ||
| Otros nombres | clorofluoruro | |
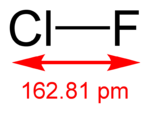
| Fórmula molecular | ClF | |
| Identificadores | ||
| Número CAS | 7790-89-8 | |
|
InChI
InChI=InChI=1S/ClF/c1-2
Key: OMRRUNXAWXNVFW-UHFFFAOYSA-N |
||
| Propiedades físicas | ||
| Apariencia | gas incoloro | |
| Masa molar | 54,45 g/mol | |
| Punto de fusión | 117,5 K (−156 °C) | |
| Punto de ebullición | 173,1 K (−100 °C) | |
| Propiedades químicas | ||
| Momento dipolar | 0.881 D | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. |
||
El monofluoruro de cloro o clorofluoruro es un compuesto químico muy interesante. Su fórmula química es ClF. Esto significa que está formado por un átomo de cloro y un átomo de flúor. En este compuesto, el cloro tiene un estado de oxidación de +1.
Contenido
¿Cómo se obtiene el monofluoruro de cloro?
Métodos de preparación del ClF
El clorofluoruro se puede crear de varias maneras en un laboratorio. Una forma es calentar una mezcla de cloro y flúor puros a 250 °C. Para que la reacción funcione mejor, se usan pequeñas virutas de cobre.
La reacción se ve así:
También es posible obtenerlo de otra forma. Se puede hacer reaccionar el trifluoruro de cloro (ClF3) con cloro puro.
Esta reacción es la siguiente:
¿Qué propiedades tiene el monofluoruro de cloro?
Características físicas del ClF
El monofluoruro de cloro es un gas que no tiene color. Si se enfría mucho, se convierte en un líquido de color amarillo muy claro. Muchas de sus características son parecidas a las del cloro y el flúor por separado.
Reacciones químicas del ClF
Este compuesto es muy reactivo. Reacciona con el agua, con muchos metales y con varios compuestos orgánicos. También puede dañar el vidrio, formando óxidos de cloro.
El clorofluoruro se usa para añadir flúor a otros compuestos. Por ejemplo, puede reaccionar con el tungsteno para formar hexafluoruro de tungsteno.
La reacción es:
También reacciona con el selenio para producir tetrafluoruro de selenio.
Esta reacción se ve así:
Además, el monofluoruro de cloro puede añadir flúor y cloro a otros compuestos. Por ejemplo, si se combina con el monóxido de carbono (CO), forma un compuesto llamado clorofluoruro de carbonilo.
La reacción es:
- CO + ClF → ClCOF
Véase también
 En inglés: Chlorine monofluoride Facts for Kids
En inglés: Chlorine monofluoride Facts for Kids