Solubilidad para niños
La solubilidad es la capacidad que tiene una sustancia, llamada soluto, de mezclarse de manera uniforme en otra sustancia, llamada disolvente. También se refiere a la cantidad máxima de soluto que se puede disolver en una cantidad específica de disolvente, bajo ciertas condiciones de temperatura y, si el soluto es un gas, también de presión.
Cuando una mezcla ya no puede disolver más soluto, se dice que está saturada. Si, en condiciones especiales, se logra disolver más soluto de lo normal, la mezcla se vuelve sobresaturada. Por el contrario, si la mezcla aún puede disolver más soluto, se llama insaturada.
Contenido
¿Qué son las disoluciones y cómo se forman?
No todas las sustancias se disuelven en el mismo disolvente. Por ejemplo, el alcohol y la sal se disuelven bien en agua, pero el aceite y la gasolina no lo hacen. Esto se debe a las características de las moléculas de cada sustancia, como si son "polares" o "apolares". Las sustancias polares suelen disolverse en disolventes polares, y las apolares en disolventes apolares.
El término "solubilidad" se usa para describir tanto el proceso de disolución como para indicar la cantidad de soluto que hay en una mezcla. La solubilidad de una sustancia depende de qué tan diferentes o similares sean el soluto y el disolvente, así como de la temperatura y la presión.
El soluto puede ser un sólido, un líquido o un gas, mientras que el disolvente suele ser un sólido o un líquido. Los gases siempre se mezclan completamente entre sí. Un sólido o un líquido solo pueden "disolverse" en un gas si primero se convierten en gas.
La solubilidad es muy importante en muchas áreas como la química, la biología, la medicina y la cocina. Por ejemplo, la mayoría de las reacciones químicas ocurren cuando las sustancias están disueltas en un disolvente. El agua es el disolvente más común.
¿Qué factores influyen en la solubilidad?
La solubilidad de una sustancia en otra depende del equilibrio de las fuerzas que unen las partículas (átomos, moléculas o iones) del disolvente y del soluto. Factores como la temperatura y la presión cambian este equilibrio y, por lo tanto, afectan la solubilidad.
La solubilidad también puede depender de la presencia de otras sustancias ya disueltas en el disolvente.
¿Cómo afecta la temperatura a la solubilidad?
La temperatura es uno de los factores más importantes.
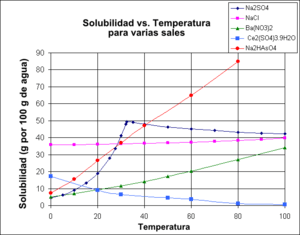
- Sólidos en líquidos: La mayoría de los sólidos se disuelven mejor en un líquido cuando la temperatura aumenta. Por ejemplo, puedes disolver más azúcar en agua caliente que en agua fría. Sin embargo, hay algunas excepciones, como el sulfato de cerio (III), que se disuelve menos en agua a medida que la temperatura sube.
- Compuestos orgánicos: La solubilidad de los compuestos orgánicos casi siempre aumenta con la temperatura. Por eso, para purificar sólidos, se usa una técnica que aprovecha que se disuelven mucho en disolvente caliente y poco en frío.
- Gases en líquidos: Los gases generalmente se disuelven menos en agua a medida que la temperatura aumenta. Por ejemplo, las bebidas gaseosas pierden su gas más rápido si están calientes. Sin embargo, en disolventes orgánicos, los gases pueden volverse más solubles con el aumento de la temperatura.
- Líquidos en líquidos: La influencia de la temperatura en la mezcla de dos líquidos puede variar mucho. A veces la solubilidad aumenta y otras disminuye. Hay casos en que dos líquidos solo se mezclan bien a bajas temperaturas.
¿Cómo afecta la presión a la solubilidad?
La presión afecta principalmente la solubilidad de los gases en líquidos. Si aumentas la presión sobre un gas, este se disolverá más en un líquido. Un ejemplo claro es el de las bebidas gaseosas: se envasan bajo alta presión para que el dióxido de carbono se disuelva en la bebida y forme burbujas al abrirla.
¿Cómo se mide la solubilidad?
La solubilidad de un soluto en un disolvente se expresa generalmente indicando la concentración de una mezcla saturada. Esto se puede hacer de varias maneras:
- Por cantidad de disolvente: Se puede expresar como la cantidad de gramos de soluto que se disuelven en 100 mililitros de disolvente (g/100 mL), o en gramos por 100 gramos de disolvente (g/100 g). También se puede usar la molalidad, que es la cantidad de moles de soluto por kilogramo de disolvente (mol/kg).
- Por cantidad de disolución: Otra forma es indicar la cantidad de soluto por la cantidad total de la mezcla (soluto más disolvente). Por ejemplo, la molaridad es la cantidad de moles de soluto por litro de disolución (mol/L). También se puede usar la fracción molar o la fracción másica, que son números entre 0 y 1 que se pueden expresar como porcentajes.
- Para líquidos y gases: Si el soluto es un líquido o un gas, las cantidades pueden expresarse en volumen, por ejemplo, litros de soluto por litro de disolvente (L/L) o por litro de disolución.
Convertir entre estas diferentes formas de medir la solubilidad puede ser complicado, ya que a veces se necesita conocer la densidad de la mezcla.
Disoluciones sólidas
En el campo de la metalurgia, una disolución sólida se refiere a cuánto un elemento se puede disolver en un metal base sin formar una fase separada. Esto es importante para crear aleaciones. El elemento "soluto" puede ocupar el lugar de otro átomo en la estructura del metal (sustitucional) o ubicarse en los espacios entre los átomos (intersticial).
En la fabricación de microelectrónica, la solubilidad sólida se refiere a la cantidad máxima de impurezas que se pueden introducir en un material.
Galería de imágenes
Véase también
 En inglés: Solubility Facts for Kids
En inglés: Solubility Facts for Kids
- Producto de solubilidad
- Soluto
- Disolvente
- Concentración
- Molaridad
- Fracción molar
- Miscibilidad
- Liposoluble
- Equilibrio químico
- Disoluciones