Equivalente para niños
El peso equivalente, también conocido como masa equivalente, es un concepto que se ha usado en química para entender cómo las sustancias reaccionan entre sí. Imagina que es la cantidad de una sustancia que se combina o reacciona con una cantidad específica de otra.
En general, el peso equivalente se refiere a la masa de una sustancia que:
- Se deposita o se libera cuando pasa una cantidad específica de electricidad (1 mol de electrones).
- Reacciona con 1 mol de iones de hidrógeno (H+) en una reacción donde un ácido y una base se neutralizan.
- Reacciona con 1 mol de electrones en una reacción donde las sustancias intercambian electrones (reacción redox).
A diferencia del peso atómico, que es solo un número, el peso equivalente tiene unidades de masa, como gramos. Al principio, estos pesos se descubrían con experimentos, pero hoy en día se calculan a partir de las masas molares de las sustancias.
Contenido
¿Cómo se descubrió el peso equivalente?
Los primeros pasos en la química
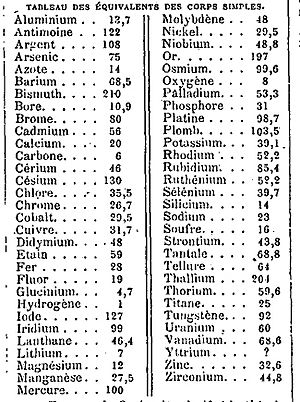
Las primeras ideas sobre el peso equivalente surgieron en el siglo XVIII. En 1777, un científico llamado Carl Friedrich Wenzel publicó tablas con los pesos equivalentes para ácidos y bases. Más tarde, en 1792, Jeremias Benjamin Richter también creó tablas similares. Sin embargo, en ese tiempo no había un punto de partida único para medir estos pesos, así que tenían que hacer tablas diferentes para cada par de ácido y base.
La idea del hidrógeno como referencia
John Dalton, en 1808, propuso una idea importante: usar el peso equivalente del hidrógeno como una unidad de medida. Esto ayudó a tener un punto de referencia. Por ejemplo, un gramo de hidrógeno reacciona con ocho gramos de oxígeno para formar nueve gramos de agua. Esto significaba que el peso equivalente del oxígeno era ocho gramos.
Sin embargo, hubo debates. Si se medían los gases por volumen, dos volúmenes de hidrógeno reaccionaban con uno de oxígeno. Esto sugería que el peso atómico del oxígeno debería ser dieciséis, no ocho. Científicos como Charles Frédéric Gerhardt, Henri Victor Regnault y Stanislao Cannizzaro trabajaron para resolver estas dudas, pero el tema siguió siendo discutido por mucho tiempo.
La utilidad de los pesos equivalentes
A pesar de los debates sobre los átomos, muchos químicos encontraron que los pesos equivalentes eran muy útiles. Ayudaron a que la química se convirtiera en una ciencia más precisa y cuantitativa. Por ejemplo, el químico francés Jean-Baptiste Dumas fue un gran defensor de usar los pesos equivalentes.
Uno de los desafíos era que algunos elementos podían formar varios compuestos con el oxígeno, teniendo así diferentes pesos equivalentes. Por ejemplo, el cobre puede formar dos tipos de óxido con el oxígeno, cada uno con una cantidad diferente de cobre por cada 8 gramos de oxígeno. Esto significaba que el cobre tenía "dos" pesos equivalentes, dependiendo de la reacción.
El fin de una era: la tabla periódica
El uso de los pesos equivalentes para los elementos empezó a disminuir con la llegada de la tabla periódica de Dmitri Mendeléyev en 1869. Esta tabla organizó los elementos según sus propiedades químicas y sus pesos atómicos, lo que simplificó mucho la comprensión de la química.
Aun así, los pesos equivalentes se siguieron usando por muchos años, especialmente en la química analítica. Eran muy útiles para hacer cálculos en el laboratorio antes de que existieran las calculadoras electrónicas.
¿Por qué se usa menos el peso equivalente hoy en día?
La masa molar: una medida más sencilla
Hoy en día, en la química general, se prefiere usar la masa molar en lugar del peso equivalente. La razón principal es que la masa molar de una sustancia es siempre la misma, sin importar la reacción en la que participe. En cambio, el peso equivalente de una sustancia puede cambiar dependiendo de la reacción.
Sin embargo, si sabemos en qué reacción participa una sustancia, podemos calcular su peso equivalente a partir de su masa molar.
Ejemplos de cálculo
- El ácido sulfúrico (H2SO4) tiene una masa molar de 98.078 gramos por mol.
- Si reacciona liberando dos iones de hidrógeno (H+), su peso equivalente es 98.078 / 2 = 49.039 gramos por equivalente.
- Pero si reacciona liberando solo un ion de hidrógeno, su peso equivalente es 98.078 / 1 = 98.078 gramos por equivalente.
- El permanganato de potasio (KMnO4) tiene una masa molar de 158.034 gramos por mol.
- En un ambiente ácido, reacciona con cinco electrones, así que su peso equivalente es 158.034 / 5 = 31.607 gramos por equivalente.
- En otros ambientes, puede reaccionar con uno o tres electrones, y su peso equivalente cambiará a 158.034 / 1 = 158.034 gramos por equivalente o 158.034 / 3 = 52.678 gramos por equivalente, respectivamente.
Históricamente, el peso equivalente de los elementos se determinaba a menudo estudiando cómo reaccionaban con el oxígeno. Por ejemplo, si 50 gramos de cinc reaccionan con oxígeno para formar 62.24 gramos de óxido de cinc, significa que 12.24 gramos de oxígeno se combinaron con el cinc. Para encontrar el peso equivalente del cinc, se calcula cuánto cinc reacciona con 8 gramos de oxígeno (que es el peso equivalente del oxígeno). En este caso, sería 50 g × 8 g / 12.24 g = 32.7 g.
Galería de imágenes
Véase también
 En inglés: Equivalent (chemistry) Facts for Kids
En inglés: Equivalent (chemistry) Facts for Kids