Estequiometría para niños
La estequiometría es una parte de la química que nos ayuda a entender y calcular las cantidades exactas de las sustancias que participan en una reacción química. Imagina que es como una receta de cocina, pero para los elementos y compuestos químicos. Nos dice cuánto de cada "ingrediente" necesitamos y cuánto "producto" obtendremos.
El científico Jeremias Benjamin Richter fue el primero en hablar de la estequiometría en 1792. Él la describió como la ciencia que mide las proporciones y las cantidades de los elementos químicos que se unen en una reacción. También nos ayuda a saber cómo se combinan los elementos en un compuesto y cómo se mezclan diferentes sustancias.
Por ejemplo, la estequiometría nos dice que:
- 4 gramos de hidrógeno (H2) reaccionan con 32 gramos de oxígeno (O2) para formar 36 gramos de agua (H2O).
- O, en términos de "moles" (una forma de contar partículas), 2 moles de H2 reaccionan con 1 mol de O2 para dar 2 moles de H2O.
Contenido
- Estequiometría: La Receta de la Química
- Galería de imágenes
- Véase también
Estequiometría: La Receta de la Química
¿Qué es la Estequiometría?
La estequiometría es la rama de la química que se encarga de medir las cantidades de las sustancias que participan en una reacción química. Nos permite saber cuánto de cada sustancia se necesita para que una reacción ocurra y cuánto se formará de las nuevas sustancias. Es fundamental para entender cómo se transforman las sustancias en el mundo.
El Principio Clave: La Conservación de la Materia
Una reacción química ocurre cuando las sustancias cambian su identidad. Esto significa que las sustancias iniciales, llamadas reactivos, se transforman para crear nuevas sustancias, llamadas productos.
¿Por qué los átomos no desaparecen?
A nivel muy pequeño, una reacción química sucede cuando las partículas (como moléculas, átomos o iones) chocan entre sí. Estos choques pueden romper las uniones que existían entre los átomos y formar nuevas uniones. Es como si los átomos se reordenaran. Lo importante es que los átomos que participan no desaparecen ni se crean nuevos átomos. Esto se conoce como la ley de conservación de la masa.
Esta ley tiene dos principios muy importantes:
- El número total de átomos antes y después de la reacción química es el mismo.
- El número de átomos de cada tipo (por ejemplo, de oxígeno o de hidrógeno) es igual antes y después de la reacción.
Además, las partículas más pequeñas dentro de los átomos (como protones, neutrones y electrones) tampoco desaparecen. Su número total se mantiene constante. Como los protones tienen carga positiva y los electrones tienen carga negativa, la suma total de las cargas eléctricas tampoco cambia. Esto se llama la ley de conservación de la carga.
Gracias a estas leyes de conservación, podemos usar ecuaciones matemáticas para describir las reacciones químicas y calcular las cantidades de sustancias. A estas ecuaciones las llamamos ecuaciones estequiométricas.
Las Ecuaciones Químicas: El Lenguaje de la Química
Una ecuación química es una forma escrita de representar una reacción química. Utiliza símbolos químicos para mostrar qué átomos están involucrados y cómo se agrupan antes y después de la reacción.
Por ejemplo, en la reacción: 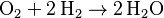
Aquí vemos los grupos de átomos (moléculas) de O2, H2 y H2O.
¿Qué significan los números en una ecuación?
En una ecuación química, hay dos tipos de números importantes:
- Subíndices: Son los números pequeños que aparecen debajo y a la derecha de un símbolo químico (como el "2" en H2O). Indican cuántos átomos de ese tipo forman una molécula. Por ejemplo, H2O significa que una molécula de agua tiene 2 átomos de hidrógeno y 1 átomo de oxígeno (cuando no hay subíndice, se entiende que es 1).
- Coeficientes estequiométricos: Son los números grandes que se escriben delante de una molécula (como el "2" en 2H2O). Indican cuántas moléculas de ese tipo participan en la reacción. Si no hay un número, se entiende que es 1.
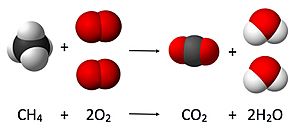
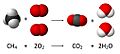
Veamos un ejemplo: 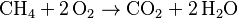
Aquí, el coeficiente del metano (CH4) es 1 (no se escribe), el del oxígeno (O2) es 2, el del dióxido de carbono (CO2) es 1 y el del agua (H2O) es 2.
Entonces, esta ecuación se lee así: «Una molécula de metano (CH4) reacciona químicamente con dos moléculas de oxígeno (2 O2) para formar una molécula de dióxido de carbono (CO2) y dos moléculas de agua (2 H2O)».
La flecha (→) nos dice que las sustancias de la izquierda (reactivos) se transforman en las sustancias de la derecha (productos).
Balanceando Ecuaciones: Asegurando el Equilibrio
Una ecuación química está "balanceada" o "ajustada" cuando cumple con la ley de conservación de la materia. Esto significa que la cantidad de átomos de cada elemento debe ser la misma en el lado de los reactivos (antes de la flecha) y en el lado de los productos (después de la flecha).
Para balancear una ecuación, solo podemos cambiar los coeficientes (los números grandes delante de las moléculas), ¡nunca los subíndices! Si cambiamos los subíndices, estaríamos hablando de una sustancia diferente. Por ejemplo, H2O es agua, pero H2O2 es peróxido de hidrógeno, que es una sustancia muy distinta. Al cambiar los coeficientes, solo indicamos que usamos más o menos cantidad de una sustancia.
Tomemos el ejemplo de la combustión del metano (CH4), que se combina con oxígeno molecular (O2) para formar dióxido de carbono (CO2) y agua (H2O). La ecuación sin ajustar sería: 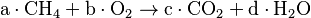
Las letras a, b, c y d son los coeficientes que necesitamos encontrar para balancear la ecuación. Hay varios métodos para hacerlo.
Método de Tanteo: Ajustando por Prueba y Error
Este método consiste en ir probando diferentes coeficientes hasta que la cantidad de átomos de cada elemento sea igual en ambos lados de la ecuación. No es un método rígido, pero hay algunos consejos:
- Empieza por los elementos que aparecen menos veces en la ecuación.
- Deja el oxígeno y el hidrógeno para el final.
Siguiendo el ejemplo del metano: 1. Carbono (C): Hay 1 átomo de C en CH4 y 1 átomo de C en CO2. Ya está balanceado con coeficientes de 1 para CH4 y CO2. 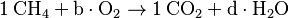 2. Hidrógeno (H): Hay 4 átomos de H en CH4. En el lado de los productos, H2O tiene 2 átomos de H. Para tener 4 átomos de H, necesitamos 2 moléculas de H2O (2 x 2 = 4). Así que d = 2. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{CH_4 + b \cdot O_2 \to CO_2 + 2\,H_2O} 3. Oxígeno (O): Ahora contamos el oxígeno. En el lado de los productos, CO2 tiene 2 átomos de O y 2H2O tiene 2 átomos de O (2 x 1 = 2). En total, hay 4 átomos de O en los productos. En el lado de los reactivos, O2 tiene 2 átomos de O. Para tener 4 átomos de O, necesitamos 2 moléculas de O2 (2 x 2 = 4). Así que b = 2.
2. Hidrógeno (H): Hay 4 átomos de H en CH4. En el lado de los productos, H2O tiene 2 átomos de H. Para tener 4 átomos de H, necesitamos 2 moléculas de H2O (2 x 2 = 4). Así que d = 2. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{CH_4 + b \cdot O_2 \to CO_2 + 2\,H_2O} 3. Oxígeno (O): Ahora contamos el oxígeno. En el lado de los productos, CO2 tiene 2 átomos de O y 2H2O tiene 2 átomos de O (2 x 1 = 2). En total, hay 4 átomos de O en los productos. En el lado de los reactivos, O2 tiene 2 átomos de O. Para tener 4 átomos de O, necesitamos 2 moléculas de O2 (2 x 2 = 4). Así que b = 2. 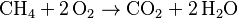
¡La ecuación está balanceada! Este método es bueno para ecuaciones sencillas.
Método Algebraico: Usando las Matemáticas
Este método es más sistemático y usa un sistema de ecuaciones. Asignamos una letra (como a, b, c, d) a cada coeficiente y luego planteamos ecuaciones para cada elemento, asegurando que el número de átomos sea igual en ambos lados.
Para el ejemplo del metano: 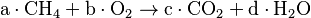
- Para el Hidrógeno (H): 4a = 2d
- Para el Oxígeno (O): 2b = 2c + d
- Para el Carbono (C): a = c
Tenemos un sistema de ecuaciones. Si resolvemos este sistema (a menudo asignando un valor de 1 a una de las letras y luego encontrando las demás), obtendremos los mismos coeficientes: a=1, b=2, c=1, d=2.
Así, la ecuación balanceada es: 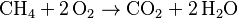
Esto nos dice que 1 molécula de metano reacciona con 2 moléculas de oxígeno para producir 1 molécula de dióxido de carbono y 2 moléculas de agua.
Proporciones y Mezclas Estequiométricas
Cuando las cantidades de los reactivos en una reacción están en las proporciones exactas que indican sus coeficientes estequiométricos, decimos que:
- La mezcla es estequiométrica.
- Los reactivos están en proporciones estequiométricas.
- La reacción ocurre en condiciones estequiométricas.
Esto significa que, si la reacción se completa, todos los reactivos se consumirán por completo, sin que sobre nada, y se formarán las cantidades exactas de productos. Si las cantidades no son estequiométricas, uno de los reactivos se acabará primero; a ese se le llama "reactivo limitante".
Cálculos Estequiométricos en la Vida Real
Los cálculos estequiométricos son muy importantes y se usan a diario en la química y en la industria. Nos permiten saber las cantidades exactas de sustancias que se necesitan para fabricar productos o para analizar muestras. La unidad clave para estos cálculos es el mol, que nos ayuda a relacionar las masas de las sustancias.
¿Cómo se usa en la medicina?
La estequiometría tiene aplicaciones prácticas en nuestra vida. Por ejemplo, cuando un médico te receta un medicamento, debe calcular la dosis exacta basándose en tu peso y la concentración del medicamento. Esto asegura que recibas la cantidad correcta para que el medicamento funcione bien y sea seguro. También es crucial en la fabricación de medicamentos, donde cada componente debe estar en la proporción precisa.
Galería de imágenes
-
Diagrama estequiométrico de la reacción de combustión del metano.
Véase también
 En inglés: Stoichiometry Facts for Kids
En inglés: Stoichiometry Facts for Kids
- Ecuación química
- Mol
- Reactivo limitante
- Ley de conservación de la materia
- Leyes estequiométricas
- Fórmula química