Johannes van der Waals para niños
Johannes Diderik van der Waals (nacido el 23 de noviembre de 1837 en Leiden, Países Bajos, y fallecido el 8 de marzo de 1923 en Ámsterdam) fue un importante profesor y físico neerlandés. Es muy conocido por su trabajo sobre cómo se comportan los gases y los líquidos, lo que le valió el Premio Nobel de Física en 1910.
Su nombre está estrechamente relacionado con la ecuación de Van der Waals, que describe el comportamiento de los gases y cómo se convierten en líquidos. También se asocia con las Fuerzas de Van der Waals (que son fuerzas de atracción entre moléculas estables), las moléculas de Van der Waals (pequeños grupos de moléculas unidas por estas fuerzas) y los radios de Van der Waals (que indican el tamaño de las moléculas). El famoso científico James Clerk Maxwell dijo una vez que el nombre de Van der Waals pronto sería uno de los más importantes en la ciencia de las moléculas.
En su tesis doctoral de 1873, Van der Waals notó que los gases reales no se comportan exactamente como los gases ideales. Explicó esto diciendo que las moléculas de los gases reales interactúan entre sí. También propuso que las moléculas ocupan un espacio, no son solo puntos sin volumen. En esa época, muchos científicos no creían en la existencia de las moléculas. Pero el trabajo de Van der Waals ayudó a demostrar que las moléculas son reales y permitió calcular su tamaño y la fuerza con la que se atraen. Su nueva fórmula cambió la forma de estudiar los gases y los líquidos.
El trabajo de Van der Waals tuvo un impacto directo y fundamental en la física de las moléculas en el siglo XX. Al incluir en su ecuación de estado parámetros que describen el tamaño y la atracción de las moléculas, Van der Waals sentó las bases de la ciencia molecular moderna. Hoy en día, se considera un hecho que las propiedades de los fluidos (como gases y líquidos) se basan en aspectos moleculares como el tamaño, la forma y las fuerzas de atracción. Gracias a su ecuación, se pudieron predecir con precisión los puntos críticos de los gases. Esto llevó a la licuefacción de gases como el nitrógeno, el oxígeno, el hidrógeno y el helio. Heike Kamerlingh Onnes se inspiró mucho en el trabajo de Van der Waals y en 1908 fue el primero en producir helio líquido, lo que lo llevó a descubrir la superconductividad en 1911.
Contenido
Biografía de Johannes Diderik van der Waals
Primeros años y educación
Johannes Diderik van der Waals nació el 23 de noviembre de 1837 en Leiden, Países Bajos. Fue el mayor de diez hijos. Su padre, Jacobus van der Waals, era carpintero. Como era común para los niños de familias trabajadoras en el siglo XIX, Johannes no fue a la escuela secundaria que le habría permitido ir a la universidad. En su lugar, asistió a una escuela de "educación primaria avanzada" y la terminó a los quince años. Luego, trabajó como aprendiz de maestro en una escuela primaria. Entre 1856 y 1861, tomó cursos y obtuvo los títulos necesarios para ser maestro y director de escuela primaria.
En 1862, comenzó a asistir a clases de matemáticas, física y astronomía en la universidad de su ciudad natal. Aunque no podía matricularse como estudiante regular porque le faltaba formación en lenguas clásicas, la Universidad de Leiden le permitió tomar hasta cuatro asignaturas al año como estudiante externo. En 1863, el gobierno holandés creó un nuevo tipo de escuela secundaria (HBS) para los hijos de las clases medias. Van der Waals, que ya era director de una escuela primaria, quiso ser profesor de matemáticas y física en una HBS y estudió durante dos años en su tiempo libre para los exámenes necesarios.
Estudió entre 1862 y 1865, obteniendo títulos en matemáticas y física. En 1865, se casó con Anna Magdalena Smit y tuvieron cuatro hijos: tres mujeres (Anne Madeleine, la poetisa Jacqueline Elisabeth y Johanna Diderica) y un varón (el físico Johannes Diderik Jr., quien también trabajó en la Universidad de Ámsterdam). Su esposa falleció de tuberculosis en 1881, a los 34 años. Después de su muerte, Van der Waals no volvió a casarse y quedó tan afectado que no publicó nada durante diez años.
En 1865, fue nombrado profesor en La Haya. En 1866, se convirtió en director de una escuela secundaria en La Haya, lo suficientemente cerca de Leiden como para que pudiera seguir sus cursos universitarios allí.
En 1873, obtuvo su doctorado con una tesis titulada Over de Continuïteit van den Gas - en Vloeistoftoestand (Sobre la continuidad de los estados líquido y gaseoso). En 1876, se convirtió en el primer profesor de física en la Universidad de Ámsterdam. Johannes falleció en Ámsterdam el 8 de marzo de 1923, un año después de la muerte de su hija Jacqueline.
Carrera como profesor
Van der Waals no tenía los conocimientos de lenguas clásicas que se requerían para ser un estudiante universitario regular y presentarse a los exámenes. Sin embargo, la ley cambió y el ministro de Educación pudo eximirlo de este requisito. Así, Van der Waals obtuvo la dispensa y aprobó los exámenes de física y matemáticas para sus estudios de doctorado.
El 14 de junio de 1873, en la Universidad de Leiden, defendió su tesis doctoral Over de Continuïteit van den Gas- en Vloeistoftoestand (sobre la continuidad del estado gaseoso y líquido), bajo la supervisión de Pieter Rijke. En esta tesis, introdujo las ideas de volumen molecular y atracción molecular.
En septiembre de 1877, Van der Waals fue nombrado el primer profesor de física en la recién fundada Universidad Municipal de Ámsterdam. Dos de sus colegas más destacados fueron el fisicoquímico Jacobus Henricus van 't Hoff y el biólogo Hugo de Vries. Van der Waals permaneció en la Universidad de Ámsterdam hasta su jubilación a los 70 años. Su hijo, Johannes Diderik van der Waals Jr., quien también era físico teórico, lo sucedió en su puesto. En 1910, a la edad de 72 años, Van der Waals recibió el Premio Nobel de Física. Falleció a los 85 años el 8 de marzo de 1923.
Investigaciones científicas
El principal interés de Van der Waals era la termodinámica, que estudia el calor y la energía. Se inspiró en un trabajo de 1857 del científico Rudolf Clausius sobre el movimiento que llamamos calor. También fue muy influenciado por los escritos de James Clerk Maxwell, Ludwig Boltzmann y Willard Gibbs. El trabajo de Clausius lo llevó a buscar una explicación para los experimentos de Thomas Andrews, quien en 1869 había descubierto las temperaturas críticas en los fluidos. Van der Waals logró describir de forma semicuantitativa la condensación y las temperaturas críticas en su tesis de 1873. Esta tesis fue un hito en la física y fue reconocida de inmediato, por ejemplo, por James Clerk Maxwell, quien la elogió en la revista Nature.
Es famoso por su trabajo en la ecuación del estado de los gases y los líquidos, por la cual ganó el Premio Nobel de Física en 1910. Van der Waals fue el primero en darse cuenta de que era necesario considerar el volumen de las moléculas y las fuerzas entre ellas (conocidas como Fuerzas de Van der Waals, que se originan por la distribución de cargas en la molécula). Así, estableció la relación entre la presión, el volumen y la temperatura de los gases y los líquidos.
También investigó sobre la disociación electrolítica (cómo se separan las sustancias en iones), la teoría termodinámica de la capilaridad (cómo los líquidos suben por tubos estrechos) y la hidrostática (el estudio de los fluidos en reposo).
Nombres en su honor
- El cráter lunar Van der Waals lleva su nombre.
- El asteroide (32893) Van der Waals también conmemora su nombre.
- Las Fuerzas de Van der Waals llevan su nombre.
- La Ecuación de Van der Waals también tiene su nombre.
La Ecuación de Van der Waals
Una contribución muy importante de Van der Waals a la termodinámica es la conocida Ecuación de Van der Waals. Mientras estudiaba en Leiden, encontró un artículo de 1857 del físico alemán Rudolf Clausius titulado Sobre la naturaleza del movimiento que llamamos calor. En este artículo, la temperatura se relacionaba con el movimiento de las moléculas y los átomos. Además, fue influenciado por los escritos de James Clerk Maxwell, Ludwig Boltzmann y Josiah Willard Gibbs. El trabajo de Clausius lo llevó a buscar una explicación para los experimentos de Thomas Andrews. Este químico y físico irlandés había descubierto la existencia de temperaturas críticas en los líquidos en 1869, pero no pudo dar una explicación teórica.
Van der Waals descubrió que la ley general de los gases de Boyle-Gay Lussac, que se expresa como:
donde:
- p = presión
- V = volumen
- n = cantidad de gas (en moles)
- R = constante de los gases
- T = temperatura en K
solo es válida en la práctica para gases muy diluidos. En esta ley, se considera que las moléculas de gas son puntos sin volumen propio y sin interacción. Van der Waals propuso un modelo diferente, donde las moléculas no son puntos sin dimensiones, sino partículas con un tamaño finito que ocupan un espacio y se atraen entre sí. Con este modelo, llegó a su ecuación de estado general:
Aquí, los parámetros a y b dependen del tipo de gas. El parámetro a describe el efecto de las fuerzas de atracción entre las moléculas. Debido a estas fuerzas, la presión que el gas ejerce sobre las paredes del recipiente es un poco menor de lo que se esperaría con la ley general de los gases. El parámetro b, llamado covolumen, tiene en cuenta que las partículas de gas tienen un volumen finito. Esto significa que tienen un poco menos de espacio para moverse que si fueran puntos sin volumen.
Las fuerzas de atracción entre las moléculas neutras en gases y líquidos se llaman ahora Fuerzas de Van der Waals. La naturaleza de estas fuerzas fue explicada más tarde por científicos como John Lennard-Jones, Fritz London y Hendrik Casimir.
Gracias a esta teoría, Van der Waals pudo explicar muchas propiedades de los gases que se observaban en experimentos, especialmente la existencia de la temperatura crítica (Tk), descubierta por Andrews.
Véase también


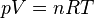
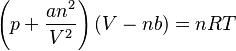
 En inglés:
En inglés: