Tampón químico para niños
Un tampón, también llamado disolución amortiguadora o disolución reguladora, es una mezcla especial de sustancias químicas. Está formada por un ácido débil y su base conjugada (o una base débil y su ácido conjugado). La característica más importante de estas disoluciones es que pueden mantener el pH de un líquido muy estable. Esto significa que, aunque se añadan pequeñas cantidades de ácidos o bases fuertes, el pH no cambia mucho.
Esta propiedad es muy importante en muchos lugares. Por ejemplo, en nuestro cuerpo, es vital que el pH se mantenga en un rango muy específico. Si el pH cambia aunque sea un poco, algunas sustancias importantes como las enzimas podrían dejar de funcionar.
Los tampones funcionan gracias a un principio llamado "efecto ion común". Cuando se añade un ácido o una base, el equilibrio de las sustancias en el tampón se ajusta para absorber ese cambio, evitando que el pH varíe drásticamente. Cada sistema tampón tiene un rango de pH en el que funciona mejor. Algunos ejemplos de tampones comunes son el ácido acético y el acetato, o el bicarbonato y el carbonato.
Contenido
¿Cómo funcionan las disoluciones tampón?
Para entender cómo un tampón mantiene el pH, imaginemos una mezcla de ácido acético y su sal, el acetato de sodio, en agua.
Cuando el acetato de sodio se disuelve en agua, se separa en iones de sodio (Na+) y iones acetato (CH3COO-): <chem>NaCH3COO -> Na+ + CH3COO-</chem>
El ácido acético (CH3COOH) es un ácido débil. Esto significa que solo una pequeña parte de él se separa en iones de hidrógeno (H+) y más iones acetato (CH3COO-): <chem>CH3COOH <=> H+ + CH3COO-</chem>
El pH de esta mezcla depende de la cantidad de iones H+ que hay.
¿Qué pasa si añades un ácido?
Si añadimos un poco de un ácido fuerte a esta mezcla, aumentará la cantidad de iones H+. Para que el pH no cambie mucho, los iones acetato (CH3COO-) que ya están en la disolución se unen a esos nuevos iones H+. Al unirse, forman más ácido acético (CH3COOH), que es una sustancia débil y no cambia tanto el pH. Así, el equilibrio se mueve para "consumir" el exceso de H+.
¿Qué pasa si añades una base?
Si añadimos una base fuerte, esta base reaccionará con los iones H+ que ya están en la disolución, disminuyendo su cantidad. Para compensar esta pérdida, el ácido acético (CH3COOH) se separa más, liberando más iones H+ y más iones acetato (CH3COO-). De esta forma, se reponen los iones H+ que se perdieron, y el pH se mantiene estable.
Cálculo del pH en disoluciones tampón
El pH de una disolución tampón se puede calcular usando una fórmula especial. Para un ácido débil (HA) y su base conjugada (A-), el equilibrio es: <chem>HA <=> H+ + A-</chem>
La relación entre estas sustancias se describe con una constante de equilibrio llamada Ka. Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): Ka = \frac{[A^-][H^+]}{[HA]}
Podemos reorganizar esta fórmula para encontrar la concentración de iones H+: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): [H^+] = Ka\cdot\frac{[HA]}{[A^-]}
Para hacer el cálculo más sencillo, los científicos usan una versión logarítmica de esta fórmula, conocida como la ecuación de Henderson-Hasselbalch: Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): pH = pKa + log\frac{[A^-]}{[HA]}
Aquí, "pKa" es un valor que nos dice qué tan fuerte es el ácido. Esta ecuación nos muestra varias cosas importantes:
- El pH de un tampón no cambia mucho si lo diluimos con agua.
- Si la cantidad del ácido (HA) es igual a la cantidad de su base conjugada (A-), entonces el pH de la disolución será igual al pKa del ácido.
- Como la fórmula usa logaritmos, se necesita un cambio muy grande en las cantidades de ácido o base para que el pH varíe significativamente. Esto demuestra lo bien que los tampones regulan el pH.
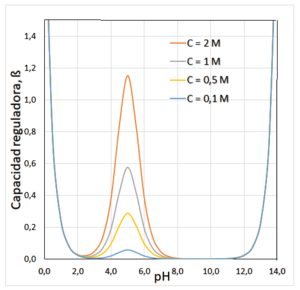
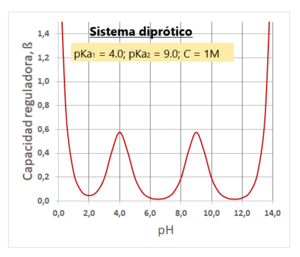
Capacidad de amortiguación de los tampones
La capacidad de amortiguación nos dice qué tan bien un tampón puede resistir los cambios de pH. Es como la "fuerza" del tampón. Se mide por la cantidad de ácido o base fuerte que se puede añadir antes de que el pH cambie mucho.
Esta capacidad depende de la cantidad de ácido y de su base conjugada que haya en la disolución. Cuanto más concentrados estén, mayor será la capacidad de amortiguación.
Algunas características importantes de la capacidad de amortiguación son:
- Es máxima cuando el pH de la disolución es igual al pKa del ácido.
- Funciona mejor en un rango de pH cercano al pKa (aproximadamente pKa ± 1). Fuera de este rango, su eficacia disminuye mucho.
- Si hay ácidos o bases muy fuertes en grandes cantidades, también pueden tener un efecto amortiguador.
- La capacidad de un tampón es mayor si hay más cantidad de sus componentes.
Sistemas tampón en el cuerpo humano
En la naturaleza, y especialmente en los seres vivos, los sistemas tampón son esenciales para mantener el pH. Por ejemplo, en nuestra sangre, el sistema tampón bicarbonato es clave para regular el pH. Dentro de nuestras células, el tampón fosfato es el principal regulador.
Niveles de pH en el cuerpo
Muchas sustancias importantes en nuestro cuerpo, como las proteínas, hormonas y enzimas, solo funcionan correctamente dentro de un rango de pH muy específico. Si el pH cambia demasiado, estas sustancias no podrían cumplir sus funciones. Por eso, los líquidos de nuestro cuerpo tienen tampones que mantienen el pH constante.
En los seres humanos, el pH de la sangre debe estar entre 7.35 y 7.45 para que todo funcione bien. Si el pH se sale de este rango, pueden ocurrir problemas de salud. Por ejemplo, un pH por debajo de 7.37 se llama acidosis, y un pH por encima de 7.43 se llama alcalosis. Estas condiciones pueden afectar el funcionamiento de órganos como los riñones o los pulmones.
Cada líquido en nuestro cuerpo tiene un nivel de pH característico:
- Sangre arterial: pH = 7.4
- Sangre venosa: pH = 7.35
- Líquido intersticial (entre las células): pH = 7.35
- Líquido dentro de las células: pH entre 6 y 7.4
- Orina: pH entre 4.5 y 8
- HCl gástrico (en el estómago): pH = 0.8
Los tampones son la primera defensa de nuestro cuerpo contra los cambios de pH. Además de los tampones, la respiración y los riñones también ayudan a mantener el equilibrio del pH.
Tipos de sistemas tampón en el organismo
Hay varios tampones importantes en nuestro cuerpo:
Inorgánicos:
- Tampón bicarbonato: Es el más importante en la sangre. Está formado por ácido carbónico (H2CO3) y bicarbonato (HCO3-).
<chem>CO2 + H2O <=> H2CO3 <=> HCO3- + H+</chem> Este sistema es muy eficaz porque el cuerpo puede eliminar el CO2 rápidamente a través de la respiración y los riñones pueden ajustar la cantidad de bicarbonato.
- Tampón fosfato: Actúa en el plasma sanguíneo y dentro de las células. Está compuesto por hidrógeno fosfato (HPO4^2-) y dihidrógeno fosfato (H2PO4-).
<chem>H2PO4- <=> HPO4^2- + H+</chem> Aunque su pKa está más cerca del pH de la sangre, se encuentra en menor concentración que el bicarbonato en la sangre. Sin embargo, es muy importante dentro de las células.
Orgánicos:
- Aminoácidos y proteínas: Los aminoácidos son las unidades que forman las proteínas. Tienen la capacidad de aceptar o donar iones H+, lo que les permite actuar como tampones. Esto se debe a sus grupos químicos especiales (amino y carboxilo).
* En ambientes ácidos, el grupo amino puede captar un protón. * En ambientes básicos, el grupo carboxilo puede perder un protón. Esta capacidad hace que las proteínas y los aminoácidos sean excelentes reguladores del pH en el cuerpo.
- Tampón hemoglobina: La hemoglobina es una proteína que se encuentra en la sangre y transporta dioxígeno. También actúa como un tampón muy eficiente. Cuando la hemoglobina libera oxígeno en los tejidos, capta iones H+, ayudando a mantener el pH de la sangre.
Usos de las disoluciones tampón en la industria
Las disoluciones tampón no solo son vitales en los seres vivos, sino que también tienen muchas aplicaciones importantes en la industria.
- En la agricultura: Se usan en la fertirrigación y la agricultura hidropónica (cultivo de plantas sin tierra). Las plantas necesitan un pH específico en el suelo o en la disolución para absorber bien los nutrientes. Si el pH cambia, las raíces pueden tener problemas para absorber minerales y pueden absorber sustancias dañinas. Cada planta tiene un pH ideal, pero la mayoría prefiere un pH ligeramente ácido (entre 5.5 y 7).
- En la industria alimentaria: El pH es un indicador importante de la calidad de los alimentos. Por ejemplo, en la carne, el pH nos dice si es apta para el consumo. En la elaboración del vino, el pH debe estar entre 2.8 y 3.5. Si el pH es más alto, algunas bacterias pueden crecer y cambiar el sabor del vino.
- En la industria farmacéutica: El control del pH es crucial en la fabricación de medicamentos.
* Al diseñar un medicamento, es necesario saber el pH de la parte del cuerpo donde actuará. Si las proteínas del medicamento se dañan con ese pH, no funcionará. * Durante la fabricación, se usan las propiedades del pH para elegir la mejor forma del medicamento. * En las pruebas de los medicamentos, se controla el pH para asegurar que los resultados sean correctos. Un pH incorrecto podría dar resultados falsos.
Véase también
 En inglés: Buffer solution Facts for Kids
En inglés: Buffer solution Facts for Kids