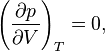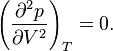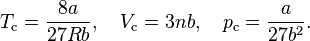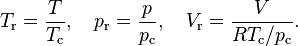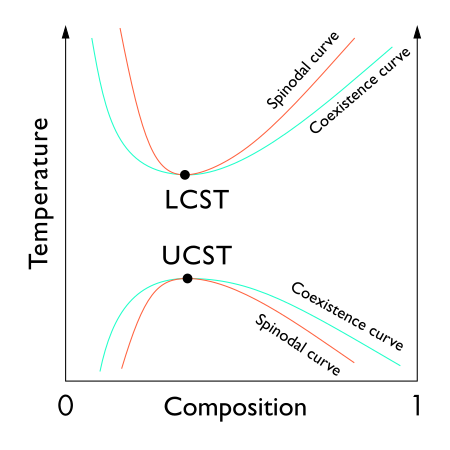Punto crítico (termodinámica) para niños
En termodinámica y en fisicoquímica, un punto crítico es aquel límite para el cual el volumen de un líquido es igual al de una masa igual de vapor o, dicho de otro modo, en el cual las densidades del líquido y del vapor son iguales. Si se miden las densidades del líquido y del vapor en función de la temperatura y se representan los resultados, puede determinarse la temperatura crítica a partir del punto de intersección de ambas curvas.
Contenido
Condiciones matemáticas del punto crítico
En el punto crítico se verifica que:
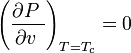
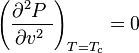
siendo 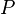 la presión,
la presión, 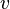 el volumen molar,
el volumen molar, 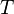 la temperatura y
la temperatura y 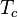 la temperatura crítica del sistema considerado.
la temperatura crítica del sistema considerado.
Punto crítico líquido–vapor
Introducción
Por simplicidad y claridad, la noción genérica de punto crítico se introduce mejor discutiendo un ejemplo específico, el punto crítico vapor-líquido. Este fue el primer punto crítico que se descubrió y sigue siendo el más conocido y estudiado.
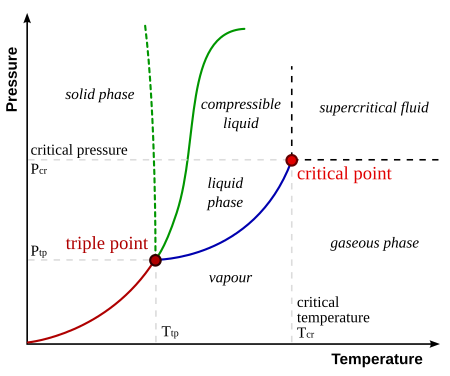
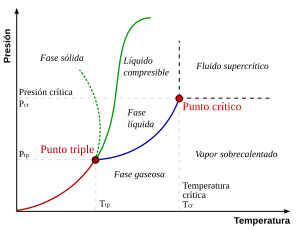
La figura de la derecha muestra el diagrama PT esquemático de una sustancia pura (a diferencia de las mezclas, que tienen variables de estado adicionales y diagramas de fase más ricos, que se analizan a continuación). Las fases comúnmente conocidas sólida, líquida y vapor están separadas por límites de fase, es decir, combinaciones de presión-temperatura donde pueden coexistir dos fases. En el punto triple, las tres fases pueden coexistir. Sin embargo, el límite líquido-vapor termina en un punto final a una temperatura crítica Tc y presión crítica pc. Este es el punto crítico.
En el agua, el punto crítico ocurre a 647.096 K (373.946 °C) y 22.064 megapascales (217.75 atm).
En las proximidades del punto crítico, las propiedades físicas del líquido y el vapor cambian drásticamente, y ambas fases se vuelven cada vez más similares. Por ejemplo, el agua líquida en condiciones normales es casi incompresible, tiene un coeficiente de expansión térmica bajo, tiene una constante dieléctrica alta y es un excelente solvente para electrolitos. Cerca del punto crítico, todas estas propiedades se transforman en exactamente lo contrario: el agua se vuelve compresible, expandible, un dieléctrico pobre, un mal solvente para los electrolitos y prefiere mezclarse con gases no polares y moléculas orgánicas.
En el punto crítico, solo existe una fase. El calor de vaporización es cero. Hay un punto de inflexión estacionario en la línea de temperatura constante ( isoterma crítica ) en un diagrama PV. Esto significa que en el punto crítico:
Por encima del punto crítico existe un estado de la materia que está continuamente conectado (puede transformarse sin transición de fase) tanto al estado líquido como al gaseoso. Se llama fluido supercrítico. Michael Fisher y Benjamin Widom, han desafiado el conocimiento común de los libros de texto de que toda distinción entre líquido y vapor desaparece más allá del punto crítico, quienes identificaron una línea p - T que separa estados con diferentes propiedades estadísticas asintóticas (línea Fisher-Widom).
A veces el punto crítico no se manifiesta en la mayoría de las propiedades termodinámicas o mecánicas, pero está "oculto" y se revela en la aparición de inhomogeneidades en los módulos elásticos, cambios marcados en la apariencia y propiedades locales de las gotas no afines, y un aumento repentino en la concentración de pares de defectos.
Historia

La existencia de un punto crítico fue descubierta por primera vez por Charles Cagniard de la Tour en 1822 y nombrado por Dmitri Mendeleev en 1860 y Thomas Andrews en 1869. Cagniard demostró que el CO2 podría licuarse a 31 °C a una presión de 73 atm, pero no a una temperatura ligeramente superior, incluso a presiones de hasta 3000 atm.
Teoría
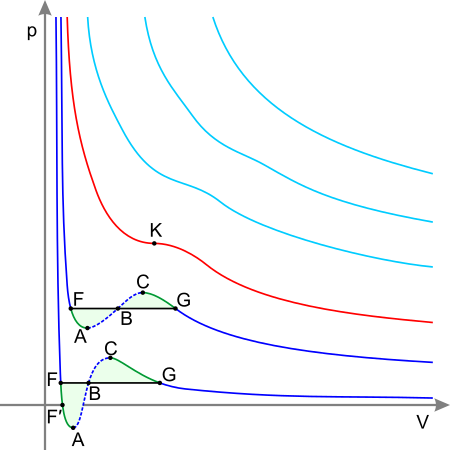
Si se resuelve la expresión antedicha 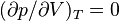 para la ecuación de van der Waals, se puede calcular el punto crítico como
para la ecuación de van der Waals, se puede calcular el punto crítico como
Sin embargo, la ecuación de van der Waals, basada en la teoría de campo medio, no es válida cerca del punto crítico.
Para analizar las propiedades de los fluidos en cercanías del punto crítico, a veces se definen variables de estado reducidas relativas a las propiedades críticas
El principio de los estados correspondientes establece que substancias con iguales presiones y temperaturas reducidas tienen iguales volúmenes reducidos. Esta relación es aproximadamente cierta para numerosas substancias, pero es muy imprecisa para valores elevados de pr.
Para algunos gases, existe un factor de corrección adicional, denominado corrección de Newton, que se agrega a la temperatura crítica y a la presión crítica calculadas de esta manera. Estos son valores derivados en forma empírica y varían dentro del rango de presiones de interés.
Mezclas: punto crítico líquido-líquido
El punto crítico líquido-líquido de una solución, que ocurre a la temperatura crítica de la solución , ocurre en el límite de la región de dos fases del diagrama de fases. En otras palabras, es el punto en el que un cambio infinitesimal en alguna variable termodinámica (como temperatura o presión) conduce a la separación de la mezcla en dos fases líquidas distintas, como se muestra en el diagrama de fases polímero-disolvente a la derecha. Dos tipos de puntos críticos líquido-líquido son la temperatura crítica superior de la solución (UCST), que es el punto más caliente en el que el enfriamiento induce la separación de fases, y la temperatura crítica inferior de la solución (LCST), que es el punto más frío en el que el calentamiento induce la fase. separación.
Definición matemática
Desde un punto de vista teórico, el punto crítico líquido-líquido representa el extremo temperatura-concentración de la curva espinodal (como se puede ver en la figura de la derecha). Por lo tanto, el punto crítico líquido-líquido en un sistema de dos componentes debe satisfacer dos condiciones: la condición de la curva espinodal (la segunda derivada de la energía libre con respecto a la concentración debe ser igual a cero) y la condición del extremo (la tercera derivada de la energía libre con respecto a la concentración también debe ser igual a cero o la derivada de la temperatura espinodal con respecto a la concentración debe ser igual a cero).
Véase también
 En inglés: Critical point (thermodynamics) Facts for Kids
En inglés: Critical point (thermodynamics) Facts for Kids
- Fluido supercrítico
- Punto de ebullición
- Punto de fusión
- Punto triple
- Teoría de las catástrofes
- Anexo:Punto crítico de los elementos químicos