Complejo exosoma para niños
El complejo exosoma es como un equipo especial de proteínas que se encarga de "limpiar" o "reciclar" diferentes tipos de ARN en las células. Imagina que el ARN es como un mensaje o una instrucción dentro de la célula; el exosoma se asegura de que los mensajes viejos o dañados se eliminen para que la célula funcione correctamente.
Este complejo se encuentra en las células de los eucariotas (como nosotros, las plantas y los animales) y en las archaeas, que son un tipo de microorganismo. En las bacterias, existe un equipo similar llamado degradosoma que hace un trabajo parecido.
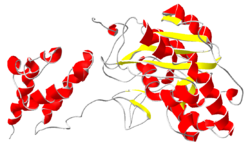
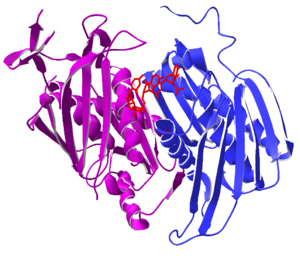
El exosoma tiene una forma central parecida a un anillo, hecha de seis proteínas, y a este anillo se le unen otras proteínas. Dentro de las células eucariotas, el exosoma está en el citoplasma (el líquido que llena la célula) y en el núcleo celular (donde se guarda el ADN), especialmente en el nucléolo. Las proteínas que trabajan con el exosoma varían según el lugar, lo que ayuda a controlar cómo y qué ARN se degrada.
Los tipos de ARN que el exosoma procesa incluyen el ARN mensajero (que lleva instrucciones para hacer proteínas), el ARN ribosómico (que forma parte de las fábricas de proteínas) y muchos otros ARN pequeños. El exosoma funciona como una "exorribonucleasa", lo que significa que corta el ARN desde uno de sus extremos (el extremo 3') en lugar de cortarlo por el medio.
Aunque el exosoma no causa enfermedades directamente, algunas de sus proteínas pueden ser reconocidas por el propio sistema de defensa del cuerpo (llamado autoanticuerpos) en ciertas enfermedades autoinmunes. También, algunos tratamientos para el cáncer pueden afectar la actividad del exosoma.
Contenido
¿Cómo se descubrió el exosoma?
El exosoma fue descubierto por primera vez en 1997 en la levadura Saccharomyces cerevisiae, que es un organismo muy usado en los laboratorios para estudiar cómo funcionan las células. Poco después, en 1999, se dieron cuenta de que este complejo de levadura era el mismo que ya se había identificado en células humanas. En humanos, se le conocía como "complejo PM/Scl" y se sabía que era un objetivo de los autoanticuerpos en pacientes con ciertas enfermedades autoinmunes.
Al estudiar el complejo humano, se pudieron identificar más proteínas que lo forman. En 2001, gracias a la información de los proyectos genoma, se predijo que las archaeas también tendrían proteínas similares al exosoma. Sin embargo, pasaron dos años más hasta que se pudo aislar y estudiar el exosoma de estos organismos.
¿Cómo está hecho el exosoma?
El exosoma es un complejo de proteínas con una estructura muy organizada.
Las proteínas principales
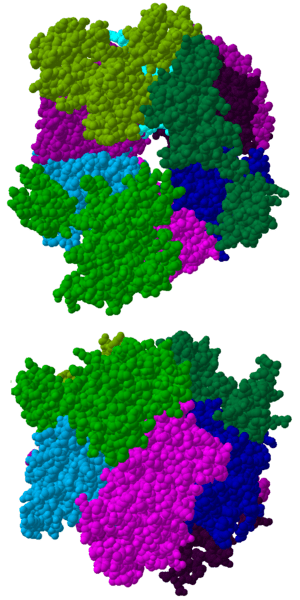
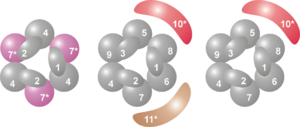
El centro del exosoma tiene una forma de anillo, como una rosquilla, y está formado por seis proteínas. Todas estas proteínas pertenecen a un grupo llamado "ARNasas PH".
- En las archaeas, este anillo se forma con dos tipos diferentes de proteínas (llamadas Rrp41 y Rrp42), que se repiten tres veces cada una.
- En las células eucariotas, el anillo está hecho de seis proteínas diferentes. Tres de ellas son parecidas a la Rrp41 de las archaeas, y las otras tres son más parecidas a la Rrp42.
En la parte superior de este anillo, se unen otras tres proteínas que tienen una parte especial para unirse al ARN, llamada dominio S1. Algunas de estas proteínas también tienen otro dominio llamado KH. En eucariotas, se unen tres proteínas S1 diferentes, mientras que en archaeas pueden ser una o dos, pero siempre hay tres unidades S1 unidas al complejo.
La estructura de este anillo es muy similar a la de otras proteínas que degradan ARN, como las ARNasas PH y las polinucleótido fosforilasas (PNPasa). Se cree que todos estos complejos están relacionados por la evolución y vienen de un antepasado común.
Proteínas que se unen al exosoma
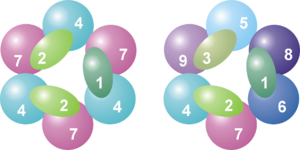
Además de las nueve proteínas principales que forman el núcleo, hay otras dos proteínas que suelen estar asociadas al exosoma en los organismos eucariotas:
- Rrp44: Es una enzima que corta el ARN usando agua. En la levadura, esta proteína siempre está unida al exosoma y es muy importante para su actividad. Curiosamente, aunque los humanos tenemos una proteína similar, no se ha encontrado que esté unida al exosoma humano.
- Rrp6 (o PM/Scl-100 en humanos): También es una enzima que corta el ARN usando agua. Esta proteína es muy común en los complejos de exosoma que están en el núcleo de las células, pero también se encuentra en el citoplasma.
Proteínas que regulan el exosoma
Muchas otras proteínas se unen al exosoma, tanto en el citoplasma como en el núcleo. Estas proteínas no están unidas de forma permanente, pero ayudan a controlar la actividad del exosoma y a decidir qué ARN debe degradar. Por ejemplo, en el citoplasma, el exosoma trabaja con proteínas que se unen a ciertas partes del ARN mensajero para decidir si debe ser degradado o no. En el núcleo, el exosoma se asocia con otras proteínas para procesar el ARN ribosómico y otros ARN pequeños.
Además de proteínas individuales, otros equipos de proteínas también interactúan con el exosoma. Por ejemplo, el complejo Ski, que ayuda a degradar el ARN mensajero, y el complejo TRAMP, que participa en el procesamiento del ARN ribosómico en el núcleo.
¿Qué hace el exosoma?
Su trabajo como enzima
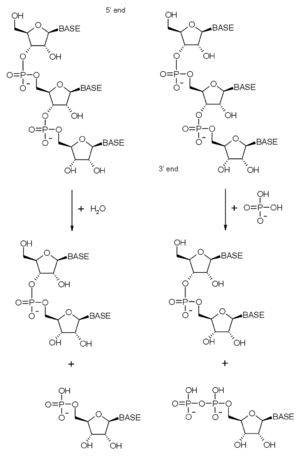
El complejo exosoma tiene muchas proteínas que actúan como enzimas, es decir, que realizan reacciones químicas. Estas enzimas tienen una actividad llamada "exorribonucleasa 3'→ 5'", lo que significa que cortan las moléculas de ARN empezando por su extremo 3'. Algunas de estas enzimas usan fosfato para cortar el ARN, liberando piezas pequeñas.
- En las archaeas, la proteína Rrp41 es la que realiza esta función.
- En las células eucariotas, las proteínas del anillo central del exosoma no tienen esta actividad enzimática. En la levadura, la proteína Rrp44 es la que hace la mayor parte del trabajo de corte. Sin embargo, en el exosoma humano, la proteína Rrp44 no está presente.
- En humanos y levaduras, otra enzima llamada Rrp6 (o PM/Scl-100) se asocia al complejo y es la principal responsable de la actividad del exosoma humano.
Los tipos de ARN que procesa
El exosoma participa en la eliminación y el procesamiento de muchos tipos de ARN.
- En el citoplasma, ayuda a reciclar las moléculas de ARN mensajero. El exosoma puede degradar ARN mensajero que tiene errores o que ya no es necesario, interactuando con otras proteínas que marcan el ARN para su eliminación.
- En el núcleo celular, el exosoma es necesario para el procesamiento correcto de varios snARN.
- En el nucléolo, que es donde se encuentra la mayor parte del exosoma, este complejo ayuda a procesar el ARN ribosómico y otros snoARN.
Aunque las células tienen otras enzimas que pueden degradar el ARN, el exosoma es esencial para que las células puedan vivir. Si se detiene o reduce la producción de las proteínas del exosoma, las células dejan de crecer y mueren.
Las bacterias no tienen exosoma, pero sus funciones las realiza un complejo similar llamado degradosoma.
El exosoma y la salud
Enfermedades autoinmunes
El complejo exosoma puede ser el objetivo de los autoanticuerpos, que son defensas del cuerpo que atacan por error a sus propias células. Esto ocurre en algunas enfermedades autoinmunes, especialmente en el síndrome de solapamiento PM-Scl. En esta enfermedad, los pacientes pueden tener síntomas de varias condiciones autoinmunes al mismo tiempo, como problemas en la piel, músculos o articulaciones.
Los autoanticuerpos se pueden detectar en la sangre de los pacientes. En el pasado, se usaban métodos como la inmunoprecipitación, donde se veía que los sueros de estos pacientes reconocían un grupo de proteínas que se llamó "complejo PM-Scl". Más recientemente, se han desarrollado pruebas más modernas para detectar estos anticuerpos.
Los anticuerpos suelen atacar principalmente a dos proteínas del exosoma: PM/Scl-100 y PM/Scl-75. Los síntomas de los pacientes pueden variar mucho, pero a menudo incluyen el Síndrome de Raynaud (problemas de circulación en dedos), artritis (inflamación de articulaciones), miositis (inflamación muscular) y esclerodermia (endurecimiento de la piel). El tratamiento busca aliviar los síntomas y a menudo implica medicamentos que regulan el sistema de defensa del cuerpo.
El exosoma y el cáncer
Se ha visto que el exosoma puede ser afectado por un medicamento llamado 5-fluorouracilo, que se usa en la quimioterapia para tratar el cáncer. Este medicamento es muy efectivo contra algunos tumores. Cuando se administra a la levadura, se observan problemas en el procesamiento del ARN ribosómico, que son similares a los que ocurren cuando se bloquea el exosoma. Como el procesamiento correcto de los ribosomas es vital para las células, este efecto ayuda a explicar por qué el medicamento es tan potente contra las células cancerosas.
Lista de subunidades
| Leyenda | Nombre general | Dominios | Homo sapiens | S. cerevisiae | Archaea | Masa molecular (kDa) | Gen humano | Gen levadura |
|---|---|---|---|---|---|---|---|---|
| 1 | Csl4 | S1 RBD | hCsl4 | Csl4p/Ski4p | Csl4 | 21-32 | HGNC EXOSC1 | YNL232W |
| 2 | Rrp4 | S1/KH RBD | hRrp4 | Rrp4p | Rrp4 | 28-39 | HGNC EXOSC2 | YHR069C |
| 3 | Rrp40 | S1/KH RBD | hRrp40 | Rrp40p | (Rrp4) | 27-32 | HGNC EXOSC3 | YOL142W |
| 4 | Rrp41 | ARNasa PH | hRrp41 | Rrp41p/Ski6p | Rrp41 | 26-28 | HGNC EXOSC4 | YGR195W |
| 5 | Rrp46 | ARNasa PH | hRrp46 | Rrp46p | (Rrp41) | 25-28 | HGNC EXOSC5 | YGR095C |
| 6 | Mtr3 | ARNasa PH PH | hMtr3 | Mtr3p | (Rrp41) | 24-37 | HGNC EXOSC6 | YGR158C |
| 7 | Rrp42 | ARNasa PH | hRrp42 | Rrp42p | Rrp42 | 29-32 | HGNC EXOSC7 | YDL111C |
| 8 | Rrp43 | ARNasa PH | OIP2 | Rrp43p | (Rrp42) | 30-44 | HGNC EXOSC8 | YCR035C |
| 9 | Rrp45 | ARNasa PH | PM/Scl-75 | Rrp45p | (Rrp42) | 34-49 | HGNC EXOSC9 | YDR280W |
| 10 | Rrp6 | ARNasa D | PM/Scl-100 | Rrp6p | n/a | 84-100 | HGNC EXOSC10 | YOR001W |
| 11 | Rrp44 | ARNasa R | (hDis3) | Rrp44p/Dis3p | n/a | 105-113 | HGNC KIAA1008 | YOL021C |
- 42: En arqueotas varias proteínas del exosoma están presentes en múltiples copias para formar el núcleo completo del complejo exosómico.
- 43: Aunque la proteína Rrp44 es parte del complejo en levadura, su homólogo humano, hDis3, no se ha encontrado nunca asociado con el complejo humano.
Galería de imágenes
Ver también
- Proteasoma: Otro complejo importante en la célula que se encarga de degradar proteínas.
- Spliceosoma: Un complejo que participa en el procesamiento del ARN, y que también tiene una estructura anular para unirse al ARN.
Véase también
 En inglés: Exosome complex Facts for Kids
En inglés: Exosome complex Facts for Kids