Calor latente para niños
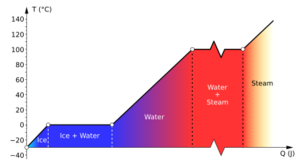
El calor latente es la energía que una sustancia necesita para cambiar de estado. Esto ocurre, por ejemplo, cuando un sólido se convierte en líquido (como el hielo que se derrite) o cuando un líquido se convierte en gas (como el agua que hierve y se vuelve vapor). Es importante saber que esta energía se usa solo para el cambio de estado, no para que la sustancia se caliente más.
La palabra "latente" viene del latín y significa "escondido". Se le llama así porque, aunque se le añada o quite energía a una sustancia, su temperatura no cambia mientras está cambiando de estado. Es como si la energía se "escondiera" en el proceso. En cambio, el calor que sí hace que la temperatura de una sustancia suba se llama calor sensible.
Imagina que calientas un trozo de hielo. Su temperatura subirá hasta que llegue a 0 °C, que es su punto de fusión. A partir de ese momento, aunque sigas dándole calor, el hielo no se calentará más. Toda la energía que le das se usará para convertir el hielo en agua. Solo cuando todo el hielo se haya derretido, el agua empezará a calentarse y su temperatura subirá.
El concepto de calor latente fue presentado por primera vez alrededor de 1762 por un científico escocés llamado Joseph Black.
Esta propiedad es muy útil en la cocina, en los sistemas de refrigeración (como tu nevera), en las bombas de calor y es la razón por la que el sudor ayuda a enfriar nuestro cuerpo.
Contenido
El Calor Latente de Diferentes Sustancias
Cada sustancia tiene sus propios valores de calor latente para la fusión (pasar de sólido a líquido) y la vaporización (pasar de líquido a gas).
| Sustancia | Fusión | Vaporización | ||||
|---|---|---|---|---|---|---|
| °C | kJ/kg | cal/g | °C | kJ/kg | cal/g | |
| Agua | 0 | 334 | 79,7 | 100 | 2265 | 539,8 |
| Amoníaco | −77,73 | 753 | 180 | −33,34 | 1369 | 327 |
Es importante recordar que el calor latente puede variar un poco si el cambio de estado ocurre a una temperatura diferente a la que se muestra en la tabla. Por ejemplo, cuando el sudor se evapora de tu piel, lo hace a una temperatura menor de 100 °C, y su calor latente es un poco distinto.
El Agua: Un Caso Especial
El agua tiene un calor de vaporización muy alto. Esto significa que necesita mucha energía para pasar de líquido a vapor. Esto se debe a que sus moléculas están unidas por "puentes de hidrógeno" que son difíciles de romper. También tiene un calor de fusión alto.
Una gran ventaja de que el agua tenga un calor de vaporización tan alto es que ayuda a los seres vivos a regular su temperatura. Por ejemplo, cuando sudamos, el agua de nuestra piel se evapora. Para evaporarse, el agua absorbe calor de nuestro cuerpo, lo que nos ayuda a enfriarnos. Otro ejemplo es cuando se riega el suelo: el agua se evapora y absorbe energía, haciendo que el ambiente se sienta más fresco.
¿Cómo Ocurren los Cambios de Estado?
Normalmente, la temperatura de una sustancia cambia cuando absorbe o libera calor. Pero, cuando una sustancia cambia de estado, absorbe o libera calor sin que su temperatura cambie. La cantidad de calor (Q) necesaria para que una masa (m) de una sustancia cambie de estado se calcula con la fórmula:
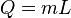
Aquí, "L" es el calor latente de la sustancia, y su valor depende del tipo de cambio de estado.
Por ejemplo, para que un kilogramo de hielo se convierta en agua a 0 °C, se necesitan 334,000 julios (o 334 kJ) de energía. Para que un kilogramo de agua se convierta en vapor a 100 °C, se necesitan 2,260,000 julios (o 2260 kJ).
Sólidos, Líquidos y Gases
Podemos entender los cambios de estado de esta manera:
- Sólidos: En un sólido, los átomos y las moléculas están muy juntos y en posiciones fijas, como si estuvieran en una red. Por eso, un sólido tiene una forma y un volumen definidos. Los átomos y moléculas vibran en su lugar, y cuanto más calor tienen, más vibran.
- Líquidos: Cuando un sólido absorbe suficiente calor, las vibraciones de sus átomos y moléculas se hacen tan fuertes que rompen las fuerzas que los mantenían fijos. Entonces, el sólido se convierte en líquido. En un líquido, los átomos y moléculas siguen unidos, pero pueden moverse unos alrededor de otros. Por eso, un líquido se adapta a la forma del recipiente que lo contiene, pero mantiene su volumen.
- Gases: Si un líquido sigue absorbiendo calor, las fuerzas que mantienen unidas a sus moléculas se rompen por completo. Las moléculas se separan mucho y se mueven libremente por todo el espacio. Un gas no tiene forma ni volumen definidos; ocupa todo el recipiente en el que se encuentra.
Véase también
 En inglés: Latent heat Facts for Kids
En inglés: Latent heat Facts for Kids
- Calor sensible
- Calorimetría
- Calor específico
- Punto de rocío
- Presión de vapor
- Punto de fusión
- Entalpía
- Energía estática húmeda