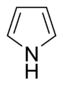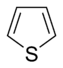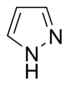Anillo aromático simple para niños
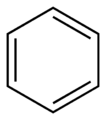
Los anillos aromáticos simples son un tipo especial de compuestos orgánicos que tienen una forma de anillo plano. Son muy estables debido a una característica llamada aromaticidad. Puedes encontrar estas estructuras en muchas moléculas importantes, como medicinas, vitaminas y colorantes.
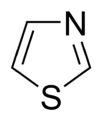
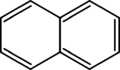
Estos anillos pueden estar formados solo por átomos de carbono, como el benceno, o pueden incluir otros átomos como oxígeno, nitrógeno o azufre. Cuando tienen otros átomos, se les llama anillos heterocíclicos. Algunos anillos son sencillos, con un solo círculo de átomos, como el benceno. Otros son más complejos, con dos o más anillos unidos, como el naftaleno o el antraceno.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
Contenido
¿Qué hace que un Anillo sea Aromático?
Para que un anillo sea considerado aromático, debe cumplir con algunas reglas especiales:
- Debe tener una forma de círculo o anillo.
- Todos los átomos en el anillo deben tener un tipo de "espacio" especial para los electrones llamado orbital p. Estos espacios deben conectarse entre sí alrededor de todo el anillo.
- La molécula debe ser plana, como una hoja de papel.
- Debe tener un número específico de electrones que se mueven libremente por el anillo. Este número se calcula con una regla llamada la regla de Hückel, que dice que debe ser 2, 6, 10, 14, etc. (es decir, 4n + 2, donde 'n' es un número entero como 0, 1, 2, 3...).
Si una molécula cumple estas reglas, es muy estable y tiene propiedades únicas. Si tiene 4n electrones en lugar de 4n+2, se considera "antiaromática" y es menos estable.
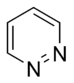
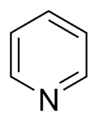
Anillos Aromáticos con Nitrógeno
Los anillos aromáticos que contienen nitrógeno (N) pueden comportarse de dos maneras:
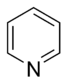
- Anillos básicos: En estos anillos, el nitrógeno tiene un par de electrones que no forma parte del sistema aromático. Este par de electrones puede "atrapar" un átomo de hidrógeno, haciendo que el anillo sea básico. Un ejemplo es la piridina.
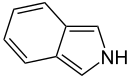
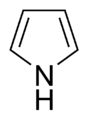
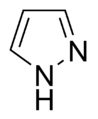
- Anillos no básicos: Aquí, el par de electrones del nitrógeno sí forma parte del sistema aromático. Esto significa que esos electrones se mueven libremente por el anillo, y el nitrógeno suele estar unido a un átomo de hidrógeno. El pirrol es un ejemplo de este tipo.
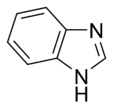
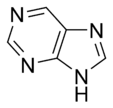
Algunos anillos, como el imidazol y la purina, pueden tener nitrógenos que se comportan de ambas maneras.
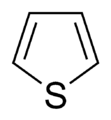
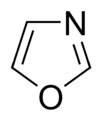
Anillos Aromáticos con Oxígeno y Azufre
Cuando los anillos aromáticos tienen oxígeno (O) o azufre (S), uno de los pares de electrones de estos átomos se une al sistema aromático, ayudando a que sea estable. El otro par de electrones se queda en el plano del anillo.
Galería de imágenes
Véase también
 En inglés: Simple aromatic ring Facts for Kids
En inglés: Simple aromatic ring Facts for Kids
- Hidrocarburos aromáticos policíclicos (PAH)
Referencias