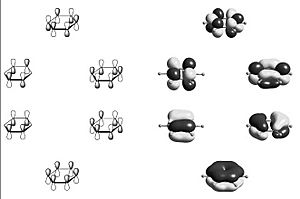Regla de Hückel para niños
La regla de Hückel es una idea importante en la química que nos ayuda a entender por qué algunas moléculas son muy estables y otras no tanto. Se usa para moléculas que tienen forma de anillo, son planas y tienen electrones que se mueven libremente. Esta regla nos dice si una molécula es "aromática" (muy estable) o "antiaromática" (menos estable).
Contenido
¿Qué es la Regla de Hückel y por qué es importante?
La regla de Hückel es como una guía para los químicos. Nos ayuda a saber si una molécula especial, que tiene forma de anillo y es plana, será muy estable o no. Esta estabilidad es clave para entender cómo reaccionan las sustancias.
¿Cómo funciona la Regla de Hückel?
La regla se basa en contar los electrones que se mueven libremente en la molécula, llamados electrones pi (π). Estos electrones están en enlaces dobles que se alternan con enlaces simples, formando un "sistema conjugado".
- Si una molécula plana y cíclica tiene 4n+2 electrones pi, es decir, 2, 6, 10, 14, etc. (donde 'n' es un número entero como 0, 1, 2, 3...), entonces es aromática. Las moléculas aromáticas son muy estables.
- Si tiene 4n electrones pi, es decir, 4, 8, 12, 16, etc., entonces es antiaromática. Las moléculas antiaromáticas son menos estables.
- Si no cumple ninguna de estas reglas, se considera "no aromática" y tiene una estabilidad normal.
Por ejemplo, el benceno es una molécula muy conocida y común en la naturaleza. Tiene 6 electrones pi (4x1+2=6), lo que la hace aromática y muy estable.
¿Qué son los electrones deslocalizados?
Imagina que los electrones son como pequeños coches que normalmente están en un carril (un enlace). Pero en las moléculas aromáticas, algunos electrones pueden moverse por varios carriles a la vez, no están fijos en un solo lugar. A esto se le llama "deslocalización". Cuando los electrones están deslocalizados, la molécula se vuelve más estable.
¿Cómo se relaciona la regla con los orbitales?
En química, los electrones se encuentran en "orbitales", que son como las zonas donde es más probable encontrarlos. Cuando los átomos se unen para formar una molécula, sus orbitales atómicos se combinan para formar "orbitales moleculares".
Cada átomo de carbono en estas moléculas tiene un electrón en un tipo de orbital llamado 'p'. Cuando estos orbitales 'p' se combinan, forman nuevos orbitales moleculares. En cada orbital molecular pueden caber dos electrones.
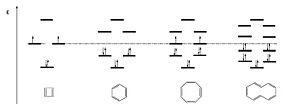
¿Por qué 4n+2 es más estable que 4n?
Los científicos han descubierto que la forma en que los electrones se organizan en los orbitales moleculares afecta mucho la estabilidad.
- Cuando una molécula tiene 4n+2 electrones pi, estos electrones pueden ocupar los orbitales de menor energía, lo que hace que la molécula sea muy estable. Es como si los electrones encontraran los asientos más cómodos y se quedaran allí.
- En cambio, si una molécula tiene 4n electrones pi, algunos de ellos tienen que ocupar orbitales de mayor energía. Esto hace que la molécula sea menos estable y, a veces, incluso cambia su forma para evitar esa inestabilidad.
La regla de Hückel fue propuesta por primera vez por el químico físico Erich Hückel en 1931. La forma sencilla de "4n+2" se hizo popular más tarde, alrededor de 1951.
Véase también
 En inglés: Hückel's rule Facts for Kids
En inglés: Hückel's rule Facts for Kids
- Partícula en un anillo
- Regla de Baird
Galería de imágenes