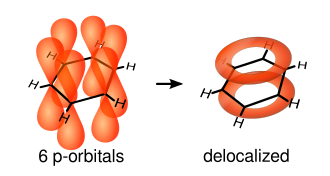Aromaticidad para niños
En la química, la aromaticidad es una característica especial de algunos compuestos químicos con forma de anillo. Imagina que los electrones de los enlaces dobles en estas moléculas no están fijos, sino que pueden moverse libremente por todo el anillo. Esta capacidad de movimiento les da una estabilidad mucho mayor de lo normal.
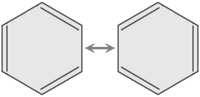
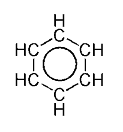
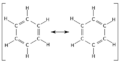
Cuando dibujamos estas moléculas, a veces mostramos los enlaces dobles en diferentes posiciones para ilustrar cómo los electrones pueden cambiar de lugar. La molécula de benceno, por ejemplo, es un gran ejemplo de esto. Sus electrones se mueven tanto que todos sus enlaces carbono-carbono son iguales, como si fueran una mezcla entre un enlace simple y uno doble.
Contenido
¿Qué es la Aromaticidad?
La aromaticidad es una propiedad que hace que ciertas moléculas cíclicas (en forma de anillo) sean muy estables. Esto ocurre cuando los electrones de los enlaces dobles pueden moverse y distribuirse por todo el anillo de átomos. Esta distribución especial de electrones le da a la molécula una fuerza y equilibrio extra.
La Resonancia: Electrones en Movimiento
En química, la idea de la resonancia nos ayuda a entender cómo se comportan estas moléculas. Cuando dibujamos una molécula con resonancia, usamos una flecha doble para indicar que ninguna de las formas dibujadas es la única y verdadera. En realidad, la molécula es una especie de "híbrido" o mezcla de todas esas formas.
Por ejemplo, en el benceno (C6H6), todos los enlaces entre los átomos de carbono tienen la misma longitud. Esto es sorprendente, porque un enlace doble (C=C) suele ser más corto que un enlace simple (C-C). Pero en el benceno, todos son iguales, con una longitud intermedia. Esto se debe a que los electrones no están fijos en un solo lugar.
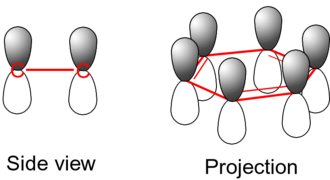
Si no pensáramos en la resonancia, veríamos enlaces simples (llamados enlaces sigma, σ) y enlaces dobles (que tienen un enlace sigma y un enlace pi, π). Los enlaces pi se forman cuando los orbitales (espacios donde se encuentran los electrones) de los átomos se superponen de lado.
Pero si aplicamos la idea de la resonancia, vemos que los seis enlaces en el anillo del benceno son idénticos. Una forma más precisa de entender esto es que hay un enlace sigma entre cada par de átomos de carbono, y además, una "nube" de electrones pi que se extiende por todo el anillo, tanto por encima como por debajo. Esta nube de electrones compartidos hace que la molécula sea muy estable.
Estos orbitales, aunque están fuera del plano del anillo, pueden interactuar libremente entre sí. Esto permite que los electrones se "deslocalicen", es decir, que se muevan por toda la molécula. Aunque no hay suficientes electrones para formar enlaces dobles en todos los lugares al mismo tiempo, esta deslocalización fortalece todos los enlaces por igual, creando una estructura muy simétrica y fuerte.
Historia de la Aromaticidad
El término "aromático" viene de una palabra griega que significa "planta de mucha fragancia". Curiosamente, no todas las sustancias aromáticas en química tienen un olor fuerte.
El químico August Wilhelm Hofmann usó por primera vez el término "aromático" en 1855 para describir compuestos que contenían un grupo llamado fenilo. Aunque muchas sustancias con olor son terpenos (que no son aromáticos en el sentido químico), Hofmann no hizo una distinción clara al principio.
La estructura del benceno, con su anillo de seis átomos de carbono, fue propuesta por August Kekulé en 1865. Muchos químicos la aceptaron porque explicaba bien cómo se comportaban estos compuestos. Sin embargo, era un misterio por qué esta estructura, que parecía tener muchos enlaces dobles, era tan poco reactiva.
La explicación de la gran estabilidad del benceno se atribuye a Robert Robinson, quien en 1925 acuñó el término "sexteto aromático". Esto se refiere a un grupo de seis electrones que son muy difíciles de alterar, lo que contribuye a la estabilidad.
Más tarde, en 1931, Hückel explicó el origen de esta estabilidad usando la mecánica cuántica. Él fue el primero en diferenciar entre los electrones sigma y los electrones pi en los enlaces.
Compuestos Aromáticos Comunes
La aromaticidad es muy común en compuestos que se parecen al benceno, como el tolueno. También se encuentra en compuestos que tienen más de un anillo o anillos con otros tipos de átomos. Incluso algunos compuestos importantes para la vida son aromáticos. Por ejemplo, las bases que forman el ADN son aromáticas. Algunos de los aminoácidos (los bloques de construcción de las proteínas) también lo son, al igual que la clorofila (que da el color verde a las plantas) y la hemoglobina (que transporta oxígeno en la sangre).
Para que un compuesto sea considerado aromático, debe cumplir con la Regla de Hückel. Esta regla dice que la cantidad de electrones pi en los orbitales del anillo debe ser un número específico: 2, 6, 10, 14, y así sucesivamente (es decir, 4n + 2, donde n es un número entero como 0, 1, 2, etc.).
¿Cómo se Mide la Aromaticidad?
Dado que el benceno es el ejemplo más claro de un compuesto aromático, los científicos han debatido si la aromaticidad es una propiedad única o si se puede medir en otros compuestos. No hay una única forma de medirla, pero se han propuesto diferentes métodos basados en:
- Criterios de Energía: Se basan en cuánta energía se necesita para ciertas reacciones. Si un compuesto es aromático, es más estable y libera menos energía de lo esperado en algunas reacciones. Por ejemplo, el benceno es mucho más estable de lo que sería si solo tuviera tres enlaces dobles fijos.
- Criterios Magnéticos: En presencia de un campo magnético, los electrones en los anillos aromáticos se mueven de una manera especial, creando un pequeño campo magnético propio. Esto se puede medir y nos da una idea de su aromaticidad.
- Criterios Geométricos: Se fijan en la forma de la molécula. Los compuestos aromáticos suelen tener enlaces de longitudes muy uniformes y son planos, lo que indica la deslocalización de los electrones.
Galería de imágenes
Véase también
 En inglés: Aromatic hydrocarbon Facts for Kids
En inglés: Aromatic hydrocarbon Facts for Kids