Reacción SN1 para niños
La reacción SN1 es un tipo de reacción de sustitución que ocurre en la química orgánica. La "SN" significa que es una sustitución nucleofílica, lo que quiere decir que una parte de una molécula (llamada nucleófilo) reemplaza a otra. El "1" indica que el paso más lento de la reacción, que es el que controla la velocidad total, solo depende de una molécula.
Esta reacción suele ocurrir en moléculas llamadas halogenuros de alquilo secundarios o terciarios, o en alcoholes secundarios y terciarios cuando hay mucho ácido. En estas reacciones, se forma un intermediario llamado carbocatión. Los químicos inorgánicos a veces llaman a la reacción SN1 un "mecanismo disociativo". El concepto de este tipo de reacción fue propuesto por primera vez por Christopher Ingold y su equipo en 1940.
Contenido
¿Cómo funciona la reacción SN1?
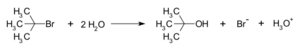
Para entender mejor, veamos un ejemplo de una reacción SN1: la hidrólisis del bromuro de tert-butilo con agua. Esto forma alcohol tert-butílico.
Esta reacción SN1 sucede en tres pasos principales:
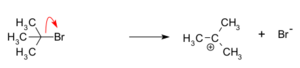
Paso 1: Formación del carbocatión
En este primer paso, una parte de la molécula, llamada grupo saliente (en este caso, un anión bromuro), se separa del átomo de carbono. Esto forma un carbocatión de tert-butilo. Este paso es lento y puede ser reversible, lo que significa que la molécula puede volver a su estado original.
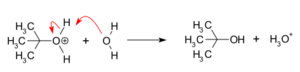
Paso 2: Ataque del nucleófilo
Una vez que se forma el carbocatión, un nucleófilo (una molécula que busca cargas positivas) lo ataca rápidamente. Si el nucleófilo es una molécula neutra, como el agua, se forma un intermediario. Cuando el agua es el solvente, este intermediario se llama ion oxonio. Este paso es muy rápido.
Paso 3: Desprotonación
Finalmente, si el nucleófilo se unió y ahora tiene un protón extra (está "protonado"), el agua actúa como una base y le quita ese protón. Esto lleva a la formación del alcohol final y un ion hidronio. Este paso también es muy rápido.
Velocidad de la reacción SN1
A diferencia de otras reacciones similares (como las SN2), las reacciones SN1 tienen dos pasos principales. El paso más lento es el primero, la formación del carbocatión. Esto significa que la velocidad total de la reacción depende solo de la concentración de la molécula inicial (el sustrato) y no de la concentración del nucleófilo que ataca.
La fórmula para la velocidad es: velocidad = k[sustrato]
A veces, la velocidad de una reacción SN1 puede aumentar mucho si se añade una pequeña cantidad de una sal, como el perclorato de litio. Esto se conoce como el efecto de la sal especial. También, si hay grupos cercanos en la molécula que pueden ayudar a estabilizar el carbocatión, la reacción puede ser más rápida de lo normal.
¿Cuándo ocurre la reacción SN1?
El mecanismo SN1 es más común cuando el átomo de carbono central está rodeado por grupos grandes. Estos grupos grandes dificultan que otras reacciones (como la SN2) ocurran. Además, estos grupos ayudan a que el carbocatión se forme más rápido, porque al hacerlo, se libera la tensión que tenían. El carbocatión que se forma también es más estable gracias a la influencia de los grupos cercanos.
Por eso, la reacción SN1 es más común en moléculas con carbonos terciarios (un carbono unido a otros tres carbonos) y también puede verse en carbonos secundarios (un carbono unido a otros dos carbonos) si el nucleófilo es débil.
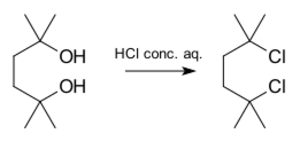
Un ejemplo de una reacción que sigue el mecanismo SN1 es la creación de 2,5-dicloro-2,5-dimetilhexano a partir de un diol (una molécula con dos grupos alcohol) usando ácido clorhídrico concentrado.
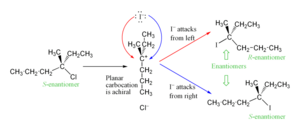
Estereoquímica: ¿Qué pasa con la forma de la molécula?
El carbocatión que se forma en el medio de la reacción SN1 es plano. Esto significa que si el carbono central tenía una forma específica (era un estereocentro), esa forma se pierde cuando se convierte en carbocatión.
Cuando el nucleófilo ataca, puede hacerlo desde cualquiera de los dos lados del plano. Por lo tanto, el producto final puede ser una mezcla de dos formas diferentes de la molécula, que son imágenes especulares una de la otra (como tus manos). A esto se le llama racemización. Esto es diferente de las reacciones SN2, donde la forma de la molécula se invierte.
Sin embargo, a veces se observa que una de las formas se produce un poco más que la otra. Esto ocurre porque el grupo que se fue puede quedarse cerca del carbocatión por un corto tiempo, bloqueando un lado y haciendo que el ataque del nucleófilo sea más probable por el otro lado.
Reacciones que pueden ocurrir al mismo tiempo
Además de la reacción SN1 principal, pueden ocurrir otras reacciones:
- Reacción de eliminación: Si la reacción se calienta, es posible que se forme un alqueno (una molécula con un doble enlace) en lugar del producto de sustitución. Esto también puede pasar si se usa un nucleófilo que es una base muy fuerte.
- Reordenamiento del carbocatión: A veces, el carbocatión que se forma puede reorganizarse para convertirse en un carbocatión más estable. Si esto sucede, el producto final será diferente al que se esperaría de una sustitución simple.
Efecto del solvente
Como la reacción SN1 forma un carbocatión inestable en su paso más lento, cualquier cosa que ayude a estabilizarlo hará que la reacción sea más rápida. Por eso, los mejores solventes para estas reacciones son los que son polares (para estabilizar las partes con carga) y próticos (para ayudar a que el grupo que se va se separe). Ejemplos de solventes próticos polares son el agua y los alcoholes, que también pueden actuar como nucleófilos.
Véase también
 En inglés: SN1 reaction Facts for Kids
En inglés: SN1 reaction Facts for Kids