Quiralidad (química) para niños
La quiralidad es una propiedad especial de algunos objetos y moléculas. Imagina tus manos: son casi iguales, pero no puedes superponer una sobre la otra de forma que coincidan perfectamente, como si fueran un guante para la misma mano. Tu mano izquierda es una imagen espejo de tu mano derecha, pero no son idénticas. Esto es la quiralidad. Un cubo o una pelota, en cambio, sí pueden superponerse con su imagen espejo.
Lord Kelvin, un científico famoso, dijo que un objeto es quiral si su imagen en un espejo no puede colocarse exactamente encima de sí mismo.
En general, un objeto quiral no tiene ciertos tipos de simetría. Si los tiene, sus imágenes en el espejo sí pueden superponerse.
Esta propiedad es muy importante en la química orgánica, la química inorgánica y la bioquímica. Gracias a ella, existen las moléculas con formas específicas y las reacciones que solo funcionan con una forma. A las dos imágenes especulares de una molécula quiral se les llama enantiómeros o isómeros ópticos.
La quiralidad es una propiedad geométrica. Se basa en cómo se reflejan las formas en un espejo. También es dicotómica, lo que significa que un objeto es quiral (no se superpone con su imagen espejo) o no quiral (sí se superpone). No hay puntos intermedios.
Los aminoácidos, carbohidratos, ácido nucleicos y muchas medicinas tienen esta propiedad. Casi todas las moléculas de nuestro cuerpo son quirales. La quiralidad molecular permite que las enzimas y otras moléculas de nuestro cuerpo se unan de forma muy específica. Esto es clave para las reacciones químicas que hacen posible la vida.
Contenido
- Quiralidad: ¿Qué es y por qué es importante?
- Véase también
Quiralidad: ¿Qué es y por qué es importante?
La quiralidad es una característica fundamental en la naturaleza. Nos ayuda a entender por qué algunas moléculas son tan especiales.
¿Por qué algunas moléculas son quirales?
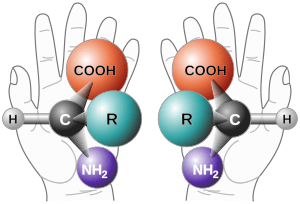
La razón más común por la que una molécula orgánica es quiral es que tiene un átomo de carbono central. Este carbono está unido a cuatro grupos o átomos diferentes. Imagina que el carbono es el centro de una estrella y tiene cuatro brazos, cada uno agarrando algo distinto.
El centro quiral: el corazón de la quiralidad
A este carbono especial se le llama centro quiral. Es la causa principal de que una molécula sea quiral. Si una molécula tiene solo un centro quiral, podemos estar seguros de que toda la molécula es quiral. Sin embargo, hay algunas moléculas con un centro quiral que no son quirales en su totalidad, pero son casos especiales. La presencia o ausencia de este centro quiral es clave para saber si una molécula es quiral.
¿Cómo se detecta la quiralidad? La actividad óptica
Las moléculas quirales tienen una propiedad muy interesante: pueden desviar la luz polarizada. Esto se llama actividad óptica.
¿Qué es la luz polarizada?
La luz normal vibra en todas las direcciones. Pero si la hacemos pasar por un filtro especial, llamado filtro polarizador, la luz empieza a vibrar en un solo plano. A esta luz se le llama luz polarizada.
¿Cómo se mide la rotación de la luz?
Cuando la luz polarizada atraviesa una sustancia quiral, su plano de vibración gira un cierto ángulo.
- Si la luz gira hacia la derecha, la sustancia se llama dextrógiro o (+).
- Si la luz gira hacia la izquierda, se llama levógiro o (-).
El científico Jean Baptiste Biot fue el primero en estudiar este fenómeno. Descubrió una ley para calcular el ángulo de rotación. Esta ley nos dice que el ángulo de rotación depende de la sustancia, de su concentración y de la distancia que la luz recorre a través de ella.
El poder rotatorio óptico es un valor único para cada sustancia quiral. Es como su huella dactilar. Los enantiómeros (las dos imágenes espejo de una molécula quiral) tienen el mismo valor de rotación, pero uno lo desvía a la derecha (+) y el otro a la izquierda (-). Si mezclamos cantidades iguales de ambos enantiómeros, la rotación se anula y el resultado es cero. A esta mezcla se le llama mezcla racémica.
Cuando la luz polarizada pasa por una molécula quiral pura, no hay nada que anule su efecto, por eso se observa la actividad óptica.
Dicroísmo circular: otra forma de ver la quiralidad
Las sustancias quirales también absorben la luz de manera diferente según cómo esté polarizada. Debido a esto, pueden cambiar el tipo de polarización de la luz que las atraviesa. Por ejemplo, una luz que entra vibrando en línea recta puede salir vibrando en forma de elipse o círculo. Este fenómeno se conoce como dicroísmo circular.
¿Cómo se nombran las moléculas quirales? Reglas R y S
Para describir la forma de un centro quiral, se usan las letras R o S. Esto se hace siguiendo unas reglas de prioridad.
Pasos para determinar R o S
1. Asigna un número de prioridad a cada uno de los cuatro grupos unidos al centro quiral. 2. Mira la molécula de forma que el grupo con la prioridad más baja (el número atómico más pequeño) quede lejos de ti. 3. Observa los otros tres grupos. Si el orden de prioridad (del 1 al 2 al 3) va en el sentido de las agujas del reloj, el centro es R (del latín rectus, que significa derecho). 4. Si el orden de prioridad va en sentido contrario a las agujas del reloj, el centro es S (del latín sinister, que significa izquierdo).
Reglas de prioridad
- Regla 1: Cuanto mayor sea el número atómico del átomo unido directamente al centro quiral, mayor será su prioridad. Por ejemplo, el bromo (Br) tiene mayor prioridad que el cloro (Cl).
- Regla 2: Si dos átomos unidos al centro quiral son iguales, se mira a los átomos siguientes en cada cadena hasta encontrar una diferencia.
- Regla 3: Si hay isótopos (átomos del mismo elemento pero con diferente masa), el isótopo más pesado tiene mayor prioridad.
- Regla 4: Los enlaces dobles o triples se tratan como si fueran enlaces simples a átomos duplicados o triplicados.
La importancia de la quiralidad en la vida
La asimetría molecular es muy común en los procesos biológicos. Por eso, la quiralidad es extremadamente importante en la biología. Aunque no todas las moléculas biológicamente activas necesitan ser quirales, cuando tienen un centro quiral, sus dos formas (enantiómeros) suelen tener actividades muy diferentes. Esto se ve en sustancias como medicinas, insecticidas y herbicidas.
Los receptores y las enzimas de nuestro cuerpo son moléculas quirales. Esto significa que son muy selectivas y solo se unen bien a una de las formas quirales de otras moléculas, como los neurotransmisores o las hormonas.
Se dice que cuanto menor sea la dosis de un medicamento que es una mezcla de enantiómeros, mayor será la diferencia en cómo actúan sus dos formas. Las moléculas que tienen la forma quiral correcta pueden encajar perfectamente en el lugar donde deben actuar en el cuerpo. Cuanto mejor encaje la molécula, más efectivo será el medicamento.
Véase también
 En inglés: Chirality Facts for Kids
En inglés: Chirality Facts for Kids
- Aquiralidad
- Actividad óptica
- Birrefringencia
- Polarización electromagnética
- Quiralidad
- Vida especular

