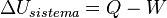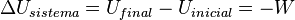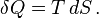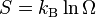Principios de la termodinámica para niños
Los cuatro principios de la termodinámica son reglas fundamentales de la física. Nos ayudan a entender cómo se comportan la temperatura, la energía y la entropía (una medida del desorden) en los sistemas. También nos dicen qué cosas son posibles y cuáles no, como la idea de una máquina que funcione para siempre sin energía (un móvil perpetuo).
Estos principios son:
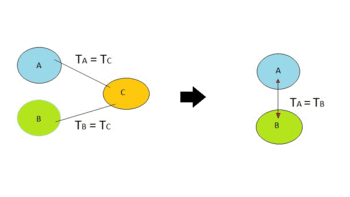
- Principio cero de la termodinámica: Nos ayuda a entender qué es la temperatura. Dice que si dos objetos están en equilibrio térmico (es decir, tienen la misma temperatura) con un tercer objeto, entonces esos dos objetos también tienen la misma temperatura entre sí.
- Primer principio de la termodinámica: Explica que la energía no se crea ni se destruye, solo se transforma. En un sistema cerrado, la energía puede cambiar de forma (como calor o trabajo) y acumularse como energía interna.
- Segundo principio de la termodinámica: Afirma que la entropía (el desorden) del universo siempre tiende a aumentar. Esto significa que los procesos naturales suelen ir hacia un estado de mayor desorden.
- Tercer principio de la termodinámica: Describe lo que sucede con la entropía cuando la temperatura se acerca al cero absoluto (la temperatura más fría posible). Dice que la entropía de un sistema se acerca a un valor constante en ese punto.
Estos principios son muy importantes y se usan en muchas otras ciencias.
Contenido
Principio Cero: El Equilibrio de la Temperatura
El principio cero de la termodinámica es una regla que se aplica a sistemas que ya están en equilibrio térmico. En palabras sencillas, este principio dice que si pones un objeto caliente en contacto con uno frío, el calor se moverá del caliente al frío hasta que ambos tengan la misma temperatura.
Este principio nos ayuda a definir la temperatura empírica (una forma de medir la temperatura). Es muy útil para construir instrumentos que miden la temperatura, como los termómetros. Sin embargo, no nos dice cómo medir la temperatura con números exactos, solo nos permite compararlas.
El equilibrio termodinámico de un sistema significa que sus propiedades (como la presión o el volumen) no cambian con el tiempo. Estas propiedades se llaman coordenadas térmicas y dinámicas.
Una forma de entenderlo es que dos sistemas están en equilibrio térmico si, aunque no estén conectados para intercambiar calor, permanecerían igual si se conectaran con una pared que solo permite el paso del calor. Este principio es clave para que podamos tener una definición matemática de la temperatura y para que los termómetros funcionen correctamente.
Aunque es un principio fundamental, se formuló después de los otros tres. Por eso se le llamó "principio cero".
Otra manera de decirlo es: si dos sistemas están en equilibrio por separado con un tercer sistema, entonces también están en equilibrio entre sí.
Primer Principio: La Energía se Conserva
El primer principio de la termodinámica se puede explicar de varias maneras:
La energía interna de un sistema cerrado aumenta si se le añade calor y se le resta el trabajo que el sistema realiza.
Para un ciclo termodinámico (un proceso que termina donde empezó), el calor que entra menos el calor que sale es igual al trabajo que el sistema realiza.
-
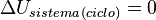 , y, por lo tanto
, y, por lo tanto 
Si un sistema está aislado y no puede intercambiar calor (es adiabático), cualquier cambio en su energía interna solo puede ser por el trabajo que se hace sobre él o que él hace.
Este principio incluye varias ideas importantes:
La energía no se crea ni se destruye. Solo cambia de forma o se mueve de un lugar a otro. La energía total de un sistema aislado siempre es la misma.
- El concepto de energía interna y su relación con la temperatura.
Si un sistema tiene una temperatura, su energía total tiene tres partes: ** energía cinética (si el sistema se mueve). ** energía potencial (si está en un campo de fuerza, como la gravedad). ** Energía interna (la energía de las partículas dentro del sistema). La energía interna es la parte más importante para la termodinámica.
:: 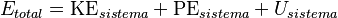
La energía interna se puede entender como la suma de las energías de movimiento de las pequeñas partículas (átomos) que forman el sistema. Cuando la temperatura de un sistema sube, la energía de movimiento de sus átomos también aumenta.
- El trabajo como transferencia de energía.
El trabajo es una forma de transferir energía a un sistema o desde él, usando fuerzas mecánicas. Por ejemplo, cuando un pistón comprime un gas, se realiza trabajo. El trabajo que hace un sistema puede venir de su energía interna, potencial o cinética.
:: 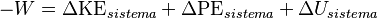
- La transferencia de materia.
Cuando la materia se mueve, la energía interna y potencial asociada a ella también se transfiere.
:: 
- El flujo de calor como transferencia de energía.
El calentamiento es la forma natural de transferir energía de un sistema a otro sin que sea por trabajo o por movimiento de materia. El calor siempre fluye de un sistema más caliente a uno más frío.
:: Si un sistema tiene paredes rígidas que no permiten el paso de materia ni de trabajo, entonces:
:: 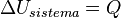 Donde Q es la cantidad de energía transferida como calor.
Donde Q es la cantidad de energía transferida como calor.
En resumen, el primer principio de la termodinámica dice que no se puede construir una máquina que produzca energía sin recibir una cantidad igual de energía. Es decir, una máquina de movimiento perpetuo de primer tipo es imposible.
Segundo Principio: La Entropía Siempre Aumenta
El segundo principio de la termodinámica dice:
La cantidad de entropía del universo tiende a incrementarse en el tiempo.
Esto significa que los procesos naturales son irreversibles. Es decir, no pueden volver atrás por sí solos. También indica que la materia y la energía tienden a distribuirse de forma más uniforme, especialmente la temperatura.
Este principio nos habla de la entropía, que es una medida del desorden o la aleatoriedad de un sistema.
El segundo principio se aplica a muchos procesos, tanto reversibles (ideales, que no ocurren en la naturaleza) como irreversibles (todos los procesos naturales).
Un ejemplo de irreversibilidad es la transferencia de calor. Cuando dos objetos con diferentes temperaturas se tocan, el calor siempre pasa del más caliente al más frío. Nunca al revés.
El segundo principio también explica otros tipos de irreversibilidad, como la fricción o las reacciones químicas. La idea de entropía es necesaria para entender completamente este principio.
Según este principio, en una transferencia de calor ideal y reversible, la cantidad de calor transferido (δQ) es el producto de la temperatura (T) por el cambio en la entropía (dS).
La entropía también se puede ver como una medida de cuánta información nos falta sobre los detalles microscópicos de un sistema, cuando solo conocemos sus propiedades generales. El principio dice que en un proceso natural, la entropía siempre aumenta. Esto significa que el estado final de un proceso natural siempre tiene más "desorden" o más formas posibles de estar organizado a nivel microscópico que el estado inicial.
Tercer Principio: El Cero Absoluto y la Entropía
El tercer principio de la termodinámica a veces se explica así:
La entropía de un cristal perfecto de cualquier sustancia pura se aproxima a cero cuando la temperatura se aproxima al cero absoluto.
El cero absoluto es la temperatura más baja posible. A esta temperatura, un sistema debería estar en su estado de energía térmica más bajo. Esto es cierto si el cristal perfecto tiene solo una forma de organizarse a nivel microscópico. La entropía se relaciona con el número de formas posibles de organización (microestados) de un sistema:
Donde S es la entropía, kB es la constante de Boltzmann y Ω es el número de microestados. En el cero absoluto, si solo hay un microestado posible (Ω=1), entonces la entropía es cero (porque ln(1) = 0).
Una forma más general de este principio, que se aplica a materiales como el vidrio (que pueden tener varios estados de energía mínima o estados "congelados"), es:
- La entropía de un sistema se acerca a un valor constante cuando la temperatura se acerca a cero.
Este valor constante (que no siempre es cero) se llama entropía residual.
Un Poco de Historia
Alrededor de 1797, el conde Rumford (Benjamin Thompson) demostró que la acción mecánica podía generar calor de forma continua, lo que desafió la idea de que el calor era una sustancia limitada.
En 1824, Nicolas Léonard Sadi Carnot formuló una idea que más tarde se convertiría en el segundo principio de la termodinámica.
Para 1860, gracias a los trabajos de Rudolf Clausius y William Thomson, los dos primeros principios de la termodinámica ya estaban bien establecidos.
En 1873, Josiah Willard Gibbs también describió claramente los dos primeros principios. Con el tiempo, lo que antes se llamaba "tercer principio" (que hablaba de la eficiencia de los motores) se unió al segundo principio. Así, el moderno tercer principio, que trata sobre la entropía en el cero absoluto, fue ampliamente aceptado.
Véase también
 En inglés: Laws of thermodynamics Facts for Kids
En inglés: Laws of thermodynamics Facts for Kids
- Ley de conservación
- Muerte térmica del universo
- Relación de reciprocidad de Onsager