Leyes de Faraday de la electrólisis para niños
Las leyes de Faraday de la electrólisis son reglas importantes que nos ayudan a entender cómo funciona la electrólisis. Fueron descubiertas por el científico Michael Faraday en 1834. Estas leyes nos dicen cuánto material se produce o se consume en un proceso de electrólisis, basándose en la cantidad de electricidad que se usa.
Contenido
¿Qué son las Leyes de Faraday de la Electrólisis?
Las leyes de Faraday de la electrólisis son dos principios fundamentales en la Electroquímica. Nos permiten calcular la cantidad de una sustancia que se forma o se separa en un electrodo durante un proceso de electrólisis. Michael Faraday, un químico y físico británico, fue quien las formuló después de muchas investigaciones.
¿Qué es la electrólisis?
La electrólisis es un proceso químico que usa la electricidad para provocar cambios en una sustancia. Imagina que tienes una sustancia disuelta en agua o fundida. Si le aplicas electricidad a través de unos objetos llamados electrodos, puedes hacer que la sustancia se separe en sus componentes o que se forme una nueva sustancia. Por ejemplo, la electrólisis se usa para obtener metales puros o para recubrir objetos con una capa de metal.
La Primera Ley de Faraday: Cantidad de Sustancia
La primera ley de Faraday nos dice que la cantidad de una sustancia que se forma en un electrodo durante la electrólisis es directamente proporcional a la cantidad de carga eléctrica que pasa por él. Esto significa que, cuanta más electricidad uses, más sustancia se producirá.
La "cantidad de electricidad" se mide en coulombs (C). Un coulomb es una unidad de carga eléctrica.
Por ejemplo:
- Para obtener 1 mol de sodio (Na) a partir de iones de sodio (Na+), se necesita 1 mol de electrones. Esto equivale a una carga de aproximadamente 96.500 culombs.
- Para obtener 1 mol de magnesio (Mg) a partir de iones de magnesio (Mg2+), se necesitan 2 moles de electrones. Esto es el doble de la carga anterior.
- Para obtener 1 mol de aluminio (Al) a partir de iones de aluminio (Al3+), se necesitan 3 moles de electrones. Esto es el triple de la carga.
La cantidad de 96.500 culombs por mol de electrones se conoce como la constante de Faraday (F).
La Segunda Ley de Faraday: Peso Equivalente
La segunda ley de Faraday explica que, si usas la misma cantidad de electricidad, la masa de diferentes sustancias que se deposita en un electrodo es directamente proporcional a su "peso equivalente".
El peso equivalente de una sustancia es su masa molar (la masa de un mol de esa sustancia) dividida por el número de electrones que participan en la reacción química. Este número de electrones depende de cómo reacciona la sustancia.
En resumen, esta ley nos dice que no todas las sustancias se producen en la misma cantidad con la misma electricidad, sino que depende de sus propiedades químicas y de cuántos electrones necesitan para reaccionar.
Las Leyes de Faraday en números
Las leyes de Faraday se pueden expresar con una fórmula matemática que las resume:
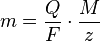
Donde:
- m es la masa de la sustancia que se produce en el electrodo (en gramos).
- Q es la carga eléctrica total que pasó por la solución (en culombs).
- F es la constante de Faraday (aproximadamente 96.485 culombs por mol de electrones).
- M es la masa molar de la sustancia (en gramos por mol).
- z es el número de electrones que la sustancia gana o pierde en la reacción (también llamado valencia o número de oxidación).
La parte 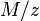 de la fórmula representa el peso equivalente de la sustancia.
de la fórmula representa el peso equivalente de la sustancia.
Si la corriente eléctrica es constante, podemos calcular la carga total (Q) multiplicando la intensidad de la corriente (I) por el tiempo (t):
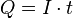
Donde:
- I es la intensidad de corriente eléctrica (en amperios).
- t es el tiempo transcurrido (en segundos).
Si sustituimos esta expresión de Q en la fórmula principal, obtenemos:
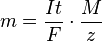
Esta fórmula nos permite calcular la masa de una sustancia producida si conocemos la intensidad de la corriente, el tiempo, la masa molar y el número de electrones involucrados.
También podemos calcular la cantidad de sustancia en moles (n) con la siguiente fórmula:
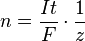
Donde:
- n es la cantidad de sustancia liberada (en moles).
Estas fórmulas son muy útiles para los científicos e ingenieros que trabajan con procesos electroquímicos en la industria.
Véase también



 En inglés:
En inglés: