Ley de conservación de la materia para niños
La Ley de conservación de la masa, también conocida como Ley de Lomonósov-Lavoisier, es una regla fundamental en las ciencias. Fue propuesta por el científico ruso Mijaíl Lomonósov en 1748 y demostrada más tarde por el químico francés Antoine Lavoisier en 1785.
Esta ley nos dice que en cualquier reacción química común que ocurre en un lugar cerrado (un sistema aislado), la cantidad total de masa antes de la reacción es exactamente igual a la cantidad total de masa después de la reacción. En otras palabras, la masa no se crea ni se destruye, solo se transforma. Los elementos que reaccionan (llamados reactivos) se reorganizan para formar nuevas sustancias (llamadas productos), pero la cantidad total de materia sigue siendo la misma.
Por ejemplo, si quemas un trozo de madera, parece que la madera desaparece. Pero si pudieras recoger todo el humo, las cenizas y los gases que se producen, y los pesaras junto con el oxígeno que se usó para la combustión, verías que la masa total es la misma que la de la madera original más el oxígeno.
Esta ley es muy precisa para las reacciones químicas que vemos a diario. Sin embargo, en procesos de muy alta energía, como los que ocurren en las estrellas o en las centrales nucleares, una pequeña parte de la masa puede convertirse en energía, y viceversa. Pero para la química de todos los días, la ley de conservación de la masa es una regla de oro.
La Ley de Conservación de la Masa
La Ley de Conservación de la Masa es un principio clave en la química. Nos ayuda a entender cómo la materia cambia de una forma a otra sin desaparecer ni aparecer de la nada.
¿Qué significa esta ley?
Significa que los átomos que forman las sustancias no se pierden ni se ganan durante una reacción química. Solo se reorganizan para formar nuevas moléculas. Imagina que tienes un juego de construcción con piezas. Puedes desarmar una figura y armar otra diferente con las mismas piezas; el número total de piezas no cambia. De la misma manera, en una reacción química, los átomos se reordenan, pero su número y su masa total se mantienen constantes.
Ejemplos de la Ley en Acción
Para entender mejor cómo funciona esta ley, veamos algunos ejemplos de la vida cotidiana y de la química.
La combustión de una vela
Cuando una vela se quema, la cera parece desaparecer. Pero en realidad, la cera se combina con el oxígeno del aire. Juntos, se transforman en dióxido de carbono (un gas), vapor de agua (otro gas) y un poco de cera que no se quemó.
- La masa de la cera original más la masa del oxígeno que se usó es igual a la masa del dióxido de carbono, el vapor de agua y la cera que quedó.
- No hay cambio en la masa total durante este proceso.
El óxido en el hierro
Seguramente has visto cómo el hierro se oxida, formando una capa rojiza. El óxido de hierro (Fe2O3) pesa más que el hierro puro. ¿Por qué?
- Esto sucede porque el hierro se combina con el oxígeno del aire.
- La nueva sustancia (el óxido) contiene la masa original del hierro más la masa del oxígeno que se unió a él.
- La reacción es: 4Fe (hierro) + 3O2 (oxígeno) → 2Fe2O3 (óxido de hierro).
- La masa total de los átomos de hierro y oxígeno antes de la reacción es igual a la masa total de los átomos en el óxido de hierro.
La formación de ácido clorhídrico
Cuando el hidrógeno gaseoso (H2) y el cloro gaseoso (Cl2) reaccionan, forman ácido clorhídrico (HCl).
- La reacción es: H2 + Cl2 → 2HCl.
- Los átomos de hidrógeno y cloro no se destruyen. Simplemente se unen de una nueva manera para formar moléculas de ácido clorhídrico.
- La masa total de los gases de hidrógeno y cloro es la misma que la masa total del ácido clorhídrico producido.
¿Tiene límites esta ley?
La Ley de Conservación de la Masa es muy precisa para las reacciones químicas normales. Sin embargo, en algunos procesos muy especiales y con mucha energía, como las reacciones nucleares (las que ocurren en el Sol o en las centrales nucleares), la masa total del sistema puede cambiar ligeramente. En estos casos, una pequeña cantidad de masa se puede transformar en una gran cantidad de energía, como lo explica la famosa idea de la equivalencia entre masa y energía de Albert Einstein. Pero para la química que estudiamos en la escuela, la ley de conservación de la masa es siempre válida.
¿Quién descubrió esta importante ley?
La idea de que la materia no se crea ni se destruye ha existido desde la antigüedad.
Primeras ideas
Filósofos antiguos como Empédocles en Grecia (siglo IV a.C.) y las enseñanzas del jainismo en la India (siglo VI a.C.) ya hablaban de que "nada viene de la nada" y que lo que existe siempre ha existido.
Los experimentos de Lavoisier
Durante el siglo XVIII, los científicos se preguntaban por qué algunos materiales parecían ganar o perder masa al quemarse. Por ejemplo, cuando un metal se oxidaba, pesaba más. Robert Boyle había notado esto en 1679.
Antoine Lavoisier fue clave para entenderlo. Él realizó experimentos muy cuidadosos en recipientes cerrados. Observó que cuando calentaba metales como el estaño o el plomo en un recipiente sellado con aire, el metal se cubría de una capa (se calcinaba), pero la masa total del recipiente y su contenido no cambiaba. Si el metal ganaba masa, el aire dentro del recipiente perdía la misma cantidad.
Con estos experimentos, Lavoisier demostró que la masa se conserva. Él fue quien formuló la ley de manera clara: "En toda reacción química, la masa se conserva, es decir, la masa total de los reactivos es igual a la masa total de los productos". Sus descubrimientos ayudaron a refutar la antigua "teoría del flogisto", que decía que una sustancia llamada flogisto se liberaba o absorbía durante la combustión, causando cambios de masa.
Mijaíl Lomonósov también había formulado esta ley en 1756, basándose en sus ideas filosóficas y experimentos, aunque los trabajos de Lavoisier fueron los que la popularizaron y la establecieron firmemente en la química moderna.

Galería de imágenes
-
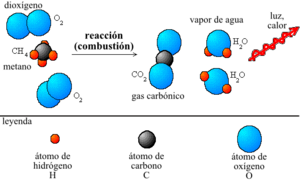
Reacción química en la cual una molécula de metano y dos moléculas de oxígeno reaccionan por combustión y se producen dos moléculas de agua y una de dióxido de carbono. Antes y después de la reacción el número de átomos de oxígeno (4), hidrógeno (4) y carbono (1) es el mismo. Por lo tanto la masa total de los reactivos, la suma de la masa de todos los átomos, es igual a la masa total de los productos. Véase estequiometría.
-
El científico ruso Mijaíl Lomonósov formuló la ley de conservación de la masa en 1756 y llegó a la conclusión de que la teoría del flogisto es incorrecta.
-
El descubrimiento de la ley de conservación de la masa por Antoine Lavoisier condujo a muchos nuevos descubrimientos en el siglo XIX. La ley de las proporciones definidas de Joseph Proust y la teoría atómica de John Dalton se derivaron de los descubrimientos de Antoine Lavoisier. Los experimentos cuantitativos de Lavoisier revelaron que en la combustión intervenía el oxígeno en lugar de lo que hasta entonces se creía que era Teoría del flogisto.
Véase también
 En inglés: Conservation of mass Facts for Kids
En inglés: Conservation of mass Facts for Kids





