Cinética química para niños
La cinética química es una parte de la fisicoquímica. Esta área de estudio se encarga de entender qué tan rápido ocurren las reacciones químicas. También investiga qué cosas pueden hacer que una reacción sea más rápida o más lenta. Es como estudiar la "velocidad" de los cambios químicos.
Contenido
¿Qué es la Cinética Química?
La cinética química nos ayuda a saber cómo cambia la velocidad de una reacción. También nos permite entender qué sucede a nivel de las moléculas durante una reacción. Por ejemplo, si las moléculas se mueven y chocan, o si necesitan la ayuda de otras sustancias.
Un Poco de Historia: ¿Quién Descubrió Esto?
El primer trabajo importante sobre cinética química lo hizo un químico alemán llamado Ludwig Wilhelmy en 1850. Él estudió cómo la sacarosa (azúcar) se transformaba en otras sustancias. Usó ecuaciones para entender la velocidad de esta reacción.
Más tarde, en 1864, Peter Waage y Cato Guldberg publicaron la ley de acción de masas. Esta ley dice que la velocidad de una reacción depende de la cantidad de las sustancias que están reaccionando.
Van 't Hoff también estudió mucho sobre la dinámica química. En 1884, publicó un libro muy importante sobre el tema. Por sus descubrimientos, recibió el primer Premio Nobel de Química en 1901.
Después de estos pioneros, la cinética química se ha centrado en medir las velocidades de las reacciones. Así se pueden entender las leyes que las rigen.
¿Cómo Medimos la Velocidad de una Reacción?
El objetivo principal de la cinética química es medir la velocidad de las reacciones. También busca entender cómo esta velocidad depende de factores como la cantidad de sustancias, la temperatura y la presencia de catalizadores.
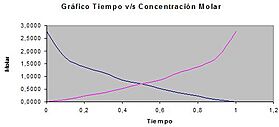
La velocidad de una reacción se puede describir midiendo cómo cambian las concentraciones de las sustancias. Esto se hace a lo largo del tiempo. La velocidad de reacción se mide en unidades de concentración por tiempo, como moles por litro por segundo (mol/(L·s)).
Imagina una reacción donde una sustancia A se convierte en B y C:
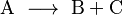
La velocidad de esta reacción se puede ver como la rapidez con la que la sustancia A desaparece. O también, la rapidez con la que las sustancias B y C aparecen.
Factores que Afectan la Velocidad de las Reacciones
Varios factores pueden hacer que una reacción química sea más rápida o más lenta. Estos incluyen la temperatura, el estado físico de los reactivos, la presencia de catalizadores y la concentración de las sustancias.
La Temperatura y la Velocidad
Generalmente, si aumentas la temperatura, la velocidad de una reacción aumenta. Esto ocurre porque las moléculas se mueven más rápido. Al moverse más rápido, chocan con más frecuencia y con más energía. Es como si tuvieran más "fuerza" para reaccionar.
La relación entre la velocidad y la temperatura se describe con la ecuación de Arrhenius. Esta ecuación nos dice que la velocidad de una reacción se duplica aproximadamente cada diez grados centígrados de aumento de temperatura.
El Estado Físico de los Materiales
Si las sustancias que reaccionan están en diferentes estados (por ejemplo, un sólido y un líquido), la reacción puede ser más lenta. Esto se debe a que el área de contacto entre ellas es menor. Si el área de contacto es mayor, la reacción es más rápida. Por ejemplo, el azúcar en polvo se disuelve más rápido que un terrón de azúcar.
El Papel de los Catalizadores
Los catalizadores son sustancias que pueden aumentar o disminuir la velocidad de una reacción. Lo hacen sin cambiarse a sí mismos de forma permanente. Los catalizadores funcionan cambiando el "camino" que sigue la reacción. Así, necesitan menos o más energía de activación para que ocurra.
Hay catalizadores que están en la misma fase que los reactivos (homogéneos). Otros están en una fase diferente (heterogéneos), como una malla de platino en algunas reacciones. Los catalizadores también pueden ser "inhibidores" o "retardantes". Estos hacen que la reacción sea más lenta.
La Concentración de los Reactivos
La mayoría de las reacciones son más rápidas si hay más cantidad de las sustancias que reaccionan. Si los reactivos están en una disolución o son gases en un recipiente, cuanta más concentración haya, más rápido reaccionarán. Esto es porque hay más partículas en el mismo espacio, lo que aumenta el número de choques entre ellas.
Por ejemplo, un ácido más concentrado reacciona de forma más fuerte con algunos metales.
La Presión en Reacciones con Gases
En las reacciones donde participan gases, una mayor presión en el sistema puede aumentar la velocidad. Esto se debe a que las moléculas de gas se mueven más rápido y chocan más. Sin embargo, la presión casi no afecta a las reacciones con líquidos o sólidos.
La Luz y las Reacciones
La luz es una forma de energía. Algunas reacciones se aceleran cuando son iluminadas. Por ejemplo, la reacción entre el cloro y el hidrógeno. La luz puede hacer que algunos átomos liberen electrones, formando iones. Esto aumenta mucho la velocidad de la reacción.
La Energía de Activación: El Empujón Necesario
En 1888, el químico sueco Svante Arrhenius propuso que las moléculas necesitan una cantidad mínima de energía para reaccionar. Esta energía proviene de la energía cinética de las moléculas cuando chocan. Si las moléculas se mueven muy lento, solo rebotarán al chocar y no habrá reacción.
Para que una reacción ocurra, las moléculas deben chocar con una energía igual o mayor que un valor mínimo. Este valor se llama energía de activación (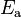 ). Una colisión con suficiente energía permite que los átomos se reorganicen y formen nuevas sustancias. Además de la energía, las moléculas también deben chocar en la posición correcta.
). Una colisión con suficiente energía permite que los átomos se reorganicen y formen nuevas sustancias. Además de la energía, las moléculas también deben chocar en la posición correcta.
La velocidad de una reacción (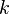 ) también depende de la temperatura. Esto se debe a que la energía cinética de las moléculas depende de ella. La relación entre
) también depende de la temperatura. Esto se debe a que la energía cinética de las moléculas depende de ella. La relación entre 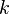 y la temperatura se describe con la ecuación de Arrhenius:
y la temperatura se describe con la ecuación de Arrhenius:
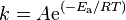
Donde 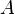 es un factor que tiene que ver con la frecuencia de los choques.
es un factor que tiene que ver con la frecuencia de los choques.
¿Qué es el Orden de Reacción?
Para cada reacción, podemos escribir una ecuación que describe cómo las partículas de los reactivos se unen para formar un producto.
Por ejemplo, en una reacción como:
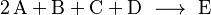
Esto podría significar que dos partículas de A chocan con una de B, una de C y una de D para formar E. Sin embargo, es muy poco probable que cinco partículas choquen al mismo tiempo.
Lo más común es que la reacción ocurra en varios pasos más pequeños. Primero, dos o tres partículas chocan y forman un "producto intermedio". Luego, este producto intermedio reacciona con otras partículas hasta formar el producto final.
El orden de reacción nos dice cómo la velocidad de una reacción depende de la concentración de cada reactivo. Se determina experimentalmente. El orden total de reacción es la suma de los órdenes de cada reactivo.
Por ejemplo, si la velocidad de una reacción se duplica cuando duplicamos la concentración de un reactivo, decimos que es de "primer orden" con respecto a ese reactivo. Si se cuadruplica, es de "segundo orden". Si no cambia, es de "orden cero".
La velocidad de una reacción se puede expresar con una ecuación como:
![v=k\mathrm{[A]}^\alpha\mathrm{[B]}^\beta](/images/math/7/e/f/7ef61dc701df47595d00fca724c6b156.png)
Aquí, 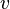 es la velocidad,
es la velocidad, 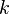 es una constante de velocidad, y los corchetes Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{[A]} y Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{[B]} representan las concentraciones de los reactivos. Los exponentes
es una constante de velocidad, y los corchetes Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{[A]} y Error al representar (Falta el ejecutable <code>texvc</code>. Véase math/README para configurarlo.): \mathrm{[B]} representan las concentraciones de los reactivos. Los exponentes 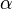 y
y 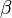 son los órdenes de reacción para cada reactivo.
son los órdenes de reacción para cada reactivo.
Las reacciones químicas pueden ocurrir a velocidades muy diferentes. Una explosión puede durar menos de un segundo, mientras que cocinar un alimento puede llevar minutos u horas.
Véase también
 En inglés: Chemical kinetics Facts for Kids
En inglés: Chemical kinetics Facts for Kids