Principio isolobal para niños
El principio isolobal es una idea muy útil en la química que nos ayuda a entender cómo se unen las partes de diferentes moléculas. Imagina que tienes piezas de construcción de distintos juegos; el principio isolobal te permite ver cuáles piezas, aunque se vean diferentes, pueden encajar de manera similar.
Este principio fue explicado por el científico Roald Hoffmann, quien ganó el Premio Nobel de Química en 1981 por sus ideas sobre cómo ocurren las reacciones químicas. Hoffmann dijo que dos fragmentos de moléculas son "isolobales" si tienen un número similar de "espacios" o "puntos" donde pueden formar nuevos enlaces. Estos puntos se llaman orbitales frontera y son como las "manos" de la molécula listas para unirse a otras.
Si dos fragmentos son isolobales, significa que se comportarán de manera parecida al formar enlaces, incluso si provienen de moléculas muy distintas. Esto es útil para predecir cómo reaccionará una sustancia nueva, basándose en el comportamiento de otra que ya conocemos bien.
Contenido
¿Cómo se Construyen los Fragmentos Isolobales?
Para entender el principio isolobal, primero necesitamos saber cómo se "construyen" estos fragmentos.
Fragmentos de Elementos Comunes
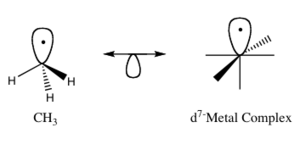
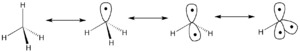
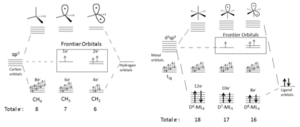
Imagina una molécula sencilla como el metano (CH4), que tiene un átomo de carbono en el centro y cuatro átomos de hidrógeno a su alrededor. Si quitamos un átomo de hidrógeno, lo que queda es un fragmento llamado radical metilo (CH3). Este fragmento tiene un "espacio" o "mano" libre donde antes estaba el hidrógeno. Este espacio es un orbital frontera.
Si seguimos quitando hidrógenos, se forman más espacios. Por ejemplo, si quitamos dos hidrógenos del metano, obtenemos CH2, que tiene dos espacios libres. Este proceso se puede repetir hasta que solo quede un enlace al átomo central.
Fragmentos de Metales de Transición
Los metales de transición son un grupo especial de elementos en la tabla periódica. Las moléculas que los contienen, llamadas complejos, también pueden formar fragmentos isolobales.
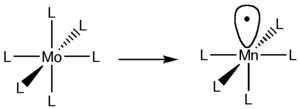
Un complejo común es el ML6, donde M es un metal y L son otras moléculas llamadas ligandos que se unen al metal. Si quitamos un ligando de un complejo como este, el metal también queda con un "espacio" libre, similar a cuando quitamos un hidrógeno del metano.
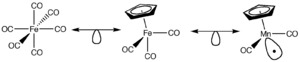
Por ejemplo, si tenemos un complejo de molibdeno (MoL6) y quitamos un ligando, el molibdeno cambia su número de electrones. Para que el fragmento resultante sea neutro (sin carga), a veces necesitamos cambiar el metal por otro que tenga un número diferente de electrones, como el manganeso (Mn). Así, el fragmento resultante de manganeso (MnL5) sería isolobal al fragmento de metano (CH3).
Relación entre Moléculas Tetraédricas y Octaédricas
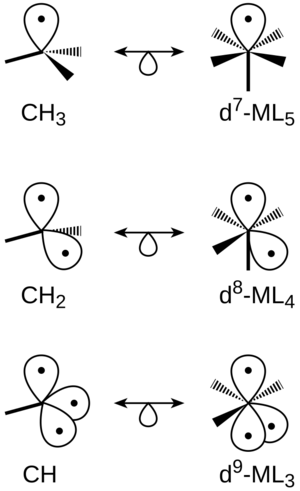
Lo interesante es que los fragmentos de moléculas con formas diferentes pueden ser isolobales entre sí. Por ejemplo, un fragmento de metano al que se le han quitado dos hidrógenos (CH2) es isolobal a un complejo metálico al que se le han quitado dos ligandos (ML4). Esto significa que ambos tienen dos "espacios" similares para formar enlaces.
De manera similar, CH3 es isolobal a ML5, y CH es isolobal a ML3. La clave es que tengan el mismo número de "manos" o "espacios" disponibles para unirse.
La Teoría de los Orbitales Moleculares y los Fragmentos Isolobales
Para entender por qué los fragmentos son isolobales, necesitamos pensar en los orbitales moleculares. Estos son como las "regiones" alrededor de los átomos donde se encuentran los electrones.
Cuando formamos un fragmento isolobal, quitamos electrones de los orbitales que forman enlaces, y esto crea nuevos "orbitales frontera". Estos orbitales frontera están en un nivel de energía más alto y cada uno tiene un electrón listo para formar un nuevo enlace.
Por ejemplo, en el metano, los enlaces se forman con orbitales híbridos. Cuando quitamos un hidrógeno, uno de esos orbitales se convierte en un orbital frontera, listo para unirse a otra cosa. Algo similar ocurre en los complejos metálicos.
Más Allá de lo Básico: Extensiones de la Analogía
El principio isolobal no solo se aplica a los ejemplos sencillos. Es mucho más amplio y puede usarse con:
- Diferentes tipos de ligandos: No solo los ligandos que donan dos electrones, sino también los que donan más, como el ciclopentadienilo, que dona seis electrones y ocupa tres "espacios" de coordinación.
- Fragmentos con carga: Si dos fragmentos son isolobales, y les añadimos o quitamos electrones de la misma manera, los nuevos fragmentos resultantes también serán isolobales.
- Complejos con otras formas: Aunque los ejemplos más comunes son los tetraédricos y octaédricos, el principio también funciona para otras formas moleculares, como los complejos cuadrado-planos.
Aplicaciones del Principio Isolobal
El principio isolobal es una herramienta muy poderosa en química. Nos ayuda a:
- Comprender la estructura electrónica: Nos da una forma sencilla de entender cómo se organizan los electrones en las moléculas.
- Predecir reacciones: Podemos predecir cómo reaccionará una molécula que no conocemos bien, comparándola con una que sí conocemos y que es isolobal. Por ejemplo, si sabemos cómo reaccionan dos fragmentos de metilo para formar etano, podemos predecir cómo reaccionarán fragmentos metálicos isolobales.
- Clasificar moléculas: Permite agrupar moléculas que, aunque parezcan diferentes, tienen un comportamiento de enlace similar.
- Imaginar nuevas moléculas: Ayuda a los científicos a pensar en posibles nuevas moléculas que aún no se han creado, basándose en la existencia de otras moléculas isolobales.
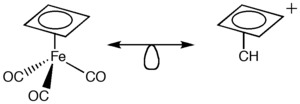
Por ejemplo, si el fragmento Fe(CO)3 es isolobal con CH+, podemos imaginar que CH+ se unirá a otras moléculas de una manera similar a como lo hace Fe(CO)3. Esto nos permite visualizar moléculas que son difíciles de sintetizar en el laboratorio.
También se usa para predecir los mecanismos de reacción, es decir, los pasos que sigue una reacción química. Si dos fragmentos son isolobales, es probable que sus reacciones sigan caminos similares.
Es importante recordar que, aunque el principio isolobal es una guía excelente, no siempre garantiza que las predicciones sean perfectas. A veces, las moléculas pueden tener otras características que las hacen comportarse de manera ligeramente diferente, como la energía de tensión en algunas estructuras. Sin embargo, es una herramienta fundamental para los químicos.
Galería de imágenes
Véase también
 En inglés: Isolobal principle Facts for Kids
En inglés: Isolobal principle Facts for Kids