Mecanismo de reacción para niños
Un mecanismo de reacción en química es como un mapa detallado que nos muestra el camino paso a paso que siguen las moléculas durante una reacción química. Nos explica qué reacciones más pequeñas (llamadas elementales) ocurren y qué sustancias temporales (llamadas intermediarios) se forman antes de llegar a los productos finales.
Conocer el mecanismo de una reacción nos ayuda a entender por qué una reacción se ve de cierta manera (por ejemplo, si cambia de color o forma un sólido) y, lo más importante, qué tan rápido ocurre. Este "mapa" debe estar basado en lo que se observa en los experimentos, como los intermediarios que se pueden detectar, la energía que se necesita en cada paso, y cómo se forman los productos.
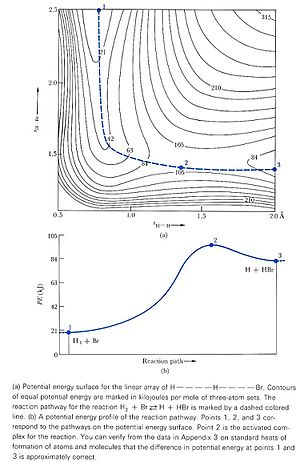
Los científicos estudian cómo cambia la energía potencial de las moléculas cuando se acercan entre sí. El científico Henry Eyring fue uno de los primeros en hacer esto, creando una especie de "paisaje" donde la altura representa la energía del sistema. En este paisaje, las moléculas se mueven de un "valle" (donde son estables) a otro, pasando por un punto alto llamado "estado de transición". Este camino es el que siguen las moléculas para transformarse en nuevos productos.
Contenido
Conceptos Clave en los Mecanismos de Reacción
Para entender mejor los mecanismos de reacción, es útil conocer algunos conceptos importantes.
¿Qué es la Energía de Activación?
Imagina que los reactivos son como una pelota en la base de una colina y los productos están al otro lado. Para que la pelota llegue al otro lado, necesita suficiente energía para subir la colina. Esa "colina" es la energía de activación. Es la energía mínima que necesitan las moléculas para chocar y reaccionar.
Cuando las moléculas de los reactivos se acercan, sus electrones pueden repelerse. Para superar esta repulsión y formar nuevos enlaces, necesitan chocar con suficiente energía cinética (energía de movimiento). En el punto más alto de esa "colina" energética, se forma algo llamado complejo activado, que es una estructura temporal donde los enlaces viejos se están rompiendo y los nuevos se están formando.
¿Qué son los Intermediarios de Reacción?
Los intermediarios de reacción son sustancias químicas que se forman durante los pasos intermedios de una reacción, pero no son los reactivos iniciales ni los productos finales. Son como "paradas" temporales en el camino. A menudo son inestables y duran muy poco tiempo, aunque a veces los científicos pueden detectarlos o incluso aislarlos. Pueden ser radicales libres o iones.
¿Cómo Afecta la Velocidad de Reacción?
La velocidad a la que ocurre una reacción química se llama cinética química. La información sobre el mecanismo de una reacción es clave para entender su velocidad. El paso más lento en un mecanismo de reacción es el que determina la velocidad general de toda la reacción. Es como un embotellamiento en una carretera: el tráfico solo puede ir tan rápido como el coche más lento.
Por ejemplo, en la reacción:
- CO + NO2 → CO2 + NO
Los experimentos muestran que la velocidad de esta reacción depende de cuántas moléculas de NO2 hay, y no del CO. Esto sugiere que el paso lento involucra a dos moléculas de NO2. Un posible mecanismo sería:
- 2 NO2 → NO3 + NO (paso lento)
- NO3 + CO → NO2 + CO2 (paso rápido)
Cada uno de estos pasos es una reacción elemental, y la suma de todos los pasos elementales nos da la reacción total.
Tipos de Reacciones Químicas
Las reacciones químicas se pueden clasificar según cómo ocurren sus mecanismos.
Reacciones Elementales (Un Paso)
Una reacción elemental ocurre en un solo paso. Esto significa que los reactivos se transforman directamente en productos, formando un solo complejo activado y superando una única barrera de energía. Se representan con una sola ecuación química.
Hay tres tipos básicos de reacciones elementales:
- Combinación: Dos o más sustancias se unen para formar una nueva sustancia (A + B → AB).
- Descomposición: Una sustancia se divide en dos o más sustancias más simples (AB → A + B).
- Desplazamiento: Un elemento reemplaza a otro en un compuesto (AB + C → AC + B).
Reacciones Complejas (Varios Pasos)
Una reacción compleja ocurre en dos o más pasos. En estas reacciones, se forman intermediarios y se superan varias barreras de energía. La ecuación química general solo muestra los reactivos iniciales y los productos finales, pero no los pasos intermedios.
¿Qué es la Molecularidad?
La molecularidad nos dice cuántas moléculas chocan en el paso más lento de una reacción elemental. Esto es útil para entender cómo se forma el estado de transición y cuánta energía se necesita.
- Unimoleculares: Solo participa una molécula.
- Bimoleculares: Participan dos moléculas.
- Trimoleculares: Participan tres moléculas.
Es muy raro que cuatro o más moléculas choquen al mismo tiempo, por lo que no existen reacciones tetramoleculares.
Ejemplo de un Mecanismo de Reacción
Veamos un ejemplo de una reacción compleja: la reacción entre el óxido nítrico (NO) y el oxígeno (O2) para formar dióxido de nitrógeno (NO2).
<chem> 2 NO(g) + O2(g) -> 2 NO2(g) </chem>
Los científicos han descubierto que esta reacción no ocurre directamente. En cambio, se ha encontrado una sustancia llamada N2O2 durante la reacción. Esto sugiere un mecanismo de dos pasos:
<chem>2 NO(g) -> N2O2(g)</chem> (primer paso, bimolecular) <chem>N2O2(g) + O2(g) -> 2 NO2(g)</chem> (segundo paso, bimolecular)
En el primer paso, dos moléculas de NO chocan para formar N2O2. Luego, el N2O2 reacciona con el O2 para formar NO2. El N2O2 es el intermediario en esta reacción.
¿Cómo se Descubren los Mecanismos?
Los científicos usan muchos experimentos para descubrir los mecanismos de reacción. Algunos de estos métodos incluyen:
- Medir cómo la temperatura afecta la velocidad de la reacción para calcular la energía de activación.
- Observar los intermediarios de reacción usando técnicas especiales como la espectroscopia.
- Estudiar la forma tridimensional de los productos (su estereoquímica).
- Ver cómo la sustitución de átomos por sus isótopos (átomos del mismo elemento con diferente número de neutrones) afecta la velocidad de la reacción.
- Usar técnicas avanzadas como la femtoquímica para observar el complejo activado directamente.
Todos estos experimentos ayudan a los científicos a construir un "mapa" preciso de cómo ocurren las reacciones químicas.
Galería de imágenes
-
Esquema del mecanismo de una reacción de eliminación E2.
Véase también
 En inglés: Reaction mechanism Facts for Kids
En inglés: Reaction mechanism Facts for Kids
- Reacción orgánica
- Mecanismo de reacción electroquímico